Какая валентность у серебра
Опубликовано: 24.07.2024
Общие сведения о валентности серебра
Серебро представляет собой металл белого цвета с гранецентрированной кубической решеткой. Серебро характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 10,5 г/см 3 . Температура плавления 961,2 o С, кипения 2170 o С.
Валентность серебра в соединениях
Серебро – сорок седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в пятом периоде в IВ группе. В ядре атома серебра содержится 47 протонов и 61 нейтрон (массовое число равно 108). В атоме серебра есть пять энергетических уровней, на которых находятся 47 электронов (рис. 1).
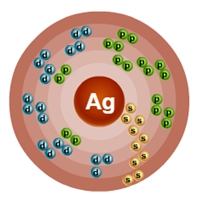
Рис. 1. Строение атома серебра.
Электронная формула атома серебра в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
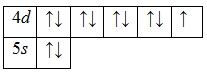
Наличие одного неспаренного электрона свидетельствует о том, что серебро проявляет валентность I в своих соединениях (Ag2O, AgNO3, AgCl, Ag2S и т.д.).
Известно, что для серебра также характерна валентность II (AgO, AgF2).
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
m (H2O)= 20 × 18 = 360 г.
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
ω (AgNO3)=40 / 400 × 100% = 10%.
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет х моль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
m (Cu) = n (Cu) × M (Cu);
m (Cu)= x × 64 = 64x.
m (Ag) = n (Ag) × M (Ag);
m (Ag)= x × 108 = 108y.
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
188х + 170у = 7,34.
Получили систему уравнений с двумя неизвестными:
![\[ \begin<cases>4х + 108у = 3 \\ 188х + 170у = 7,34 \end <cases>\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bbdc4ee63a39a240d9293928a8772950_l3.jpg)
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя x можно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
Содержание
- 1 История возникновения понятия «валентность»
- 2 Современные представления о валентности
- 3 Примечания
- 4 См. также
- 5 Ссылки
- 6 Литература
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz ) [1] . В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества [2] .

Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт [3] . Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе» (соединительном весе), положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 году он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 году взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861-го, А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.

Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х годах появились первые молекулярные модели. Уже в 1864 году А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 году А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 году в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода — двум, азота — трём, углерода — четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода — двум, азота — трём, кремния — четырём, серы — шести.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду шести (SO3). Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность [некоторые элементы могут не иметь ни гидридов, ни оксидов]. Наприм., углерод образует с кислородом два оксида: монооксид углерода CO и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырём (некоторые элементы способны образовывать также пероксиды). Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом и/или методом, как правило, нельзя.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.

В основном, под валентностью химических элементов обычно понимается способность свободных его атомов (в более узком смысле — мера его способности) к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами [4] . При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бора, углерода и азота равна 4 (например, в [BF4] − , CH4 и [NH4] + ), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно-акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления (N2, NO2, NH3 и [NH4] + ).

Кроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов в ряде случаев можно выразить [часто и отождествить] иными способами: как, например, степень окисления элемента (условный заряд атома в предположении, что вещество состоит из ионов), ковалентность (число химических связей, образуемых атомом данного элемента, в том числе и с одноимённым элементом; см. ниже), координационное число атома (число атомов, непосредственно окружающих данный атом) и т. п. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу [5] . Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN − реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей [6] — нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи (чаще в таких случаях корректнее говорить о степени окисления). Представления о валентности не применимы для описания кластерных соединений, бороводородов, карборанов, π-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений с ионной кристаллической структурой. Так в кристалле хлорида натрия NaCl у каждого иона Na + или Cl − — центра элементарной ячейки — реальное число соседних ионов — координационное число — равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае [5] . В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому [7] .
Ковалентность элемента (мера валентных возможностей элементов; ёмкость насыщения) определяется общим числом неспаренных электронов [валентных электронных пар [8] ] как в нормальном, так и в возбуждённом состоянии атома, или, иначе говоря, число образуемых атомом ковалентных связей (углерод 2s 2 2p 2 II-ковалентен, а в возбуждённом состоянии C* 2s 1 2p 3 — IV-ковалентный; таким образом в CO и CO2 валентность составляет II или IV, а ковалентность — II и/или IV). Так, ковалентность азота в молекулах N2, NH3, Al≡N и цианамиде Ca=N-C≡N равна трём, ковалентность кислорода в молекулах H2O и CO2 — двум, ковалентность углерода в молекулах CH4, CO2 и кристалле C (алмаза) — четырём.
В классическом и/или пост-квантовохимическом представлении по электронным спектрам поглощения двухатомных молекул можно определять число оптических (валентных) электронов при данной энергии возбуждения [9] . Согласно этому методу, обратная величина тангенса угла наклона корреляционной прямой/прямых (при релевантных значениях молекулярных электронных термов, которые образованы относительными суммами атомных) соответствует числу пар валентных электронов, то есть валентности в её классическом понимании [10] .
Между валентностью [стехиометрической] в данном соединении, мольной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса».
Стехиометрическая валентность [расчётная] элемента в данном соединении [11] равна молекулярной массе его атомов (в г/моль), делённой на эквивалентную массу элемента (в г/моль):
V = M E <\displaystyle V=<\frac
V — Стехиометрическая валентность
M — Молекулярная масса (г/моль)
E — Эквивалентная масса (г/моль)
Так, стехиометрическая валентность углерода в CO 12 (г/моль) /6 (г/моль) = 2, а в CO2 12 /3 = 4.
В неорганической химии во многих случаях понятие валентности элемента теряет определённость: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы (таблицы ПСХЭ ). В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как большинство неорганических веществ имеет немолекулярное строение, а органических — молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин «валентные электроны», то есть наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
По валентности элементов можно составлять истинные формулы соединений, и, наоборот, исходя из истинных формул можно определять валентности элементов в данных соединениях. При этом необходимо придерживаться принципа, согласно которому произведение валентности одного элемента на число его атомов равно произведению валентности второго элемента на число его атомов. Так, чтобы составить формулу оксида азота (III), следует записать сверху над символом валентности элементов N I I I <\displaystyle <\stackrel
O I I <\displaystyle <\stackrel
. Определив наименьший общий знаменатель и разделив его на соответствующие валентности, получим атомное соотношение азота к кислороду, а именно 2 : 3. Следовательно, формула оксида азота (III) соответствует N + 3 2 O − 2 3 <\displaystyle <\stackrel <+3><\mbox
. Для определения валентности поступают таким же образом наоборот.
Химия | 5 - 9 классы
Какая валентность у серебра?

У серебра валентность 1.
По таблице Менделеева смотри.
Поскольку этот элемент с постоянной валентностью, то смотри по номеру группы.
Серебро в первой группе, значит и валентность 1.

Составь формулы по валентности :P(валентность 5)ON(валентность 4)OS(валентность 4)OS(валентность 6)OC(валентность 4)OSi(валентность 4)OFe(валентность 3)OFe(валентность 2)OMg(валентность 2)O?
Составь формулы по валентности :

Срочно?
Даны оксиды CO ^ 2, H ^ 2O, SiO ^ 2.
Составьте формулы оксидов : S(ВАЛЕНТНОСТЬ 4), Cu(валентность 2), Fe(валентность 3), Hg( валентность 2), N(валентность 5), P( валентность 5), Se (валентность 6), Cl (валентность 7).
Составьте уравнения этих реакций.
Какие из них вступают в реакцию с водой?

Запишите уравнения реакции соединения с серой следующих металлов, зная, что валентность серы в этих соединениях равна II 1) Магния 2)Цинк 3)Серебро 4)Алюминий?
Запишите уравнения реакции соединения с серой следующих металлов, зная, что валентность серы в этих соединениях равна II 1) Магния 2)Цинк 3)Серебро 4)Алюминий.

Раствор серной кислоты реагирует с : 1)серебром 2)водородом 3)оксидом кремния(четырёх валентным) 4)оксидом меди(||)?
Раствор серной кислоты реагирует с : 1)серебром 2)водородом 3)оксидом кремния(четырёх валентным) 4)оксидом меди(||).

Как выводить формулу за валентностью и валентность за формулой ?
Как выводить формулу за валентностью и валентность за формулой ?

По обозначенной над символами химических элементов валентностью составьте соответствующие формулы соединений : Au(валентность 3)Cl, Cu(валентность 2)O, P(валентность 3)O, S(валентность 4)O, S(валентно?
По обозначенной над символами химических элементов валентностью составьте соответствующие формулы соединений : Au(валентность 3)Cl, Cu(валентность 2)O, P(валентность 3)O, S(валентность 4)O, S(валентность 6)O, Mn(валентность 4)O, P(валентность 3)H, Ni(валентность 2)O, B(валентность 3)O, Cd(валентность 2)O, W(валентность 6)O.

При взаимодействии чистого хлорида железа массой 100г с избытком нитрата серебра образовался хлорид серебра массой 265г хлорид железа 2 - х валентный или хлорид железа 3 - х валентный взят для реакции?
При взаимодействии чистого хлорида железа массой 100г с избытком нитрата серебра образовался хлорид серебра массой 265г хлорид железа 2 - х валентный или хлорид железа 3 - х валентный взят для реакции Полное решение пожалуйста).

Проверьте, пожалуйста Li2O (валентность 2) Li3N (валентность 3) LiH(валентность 1) Cu2O (валентность 1) CuO(валентность 2) Правильно?
Проверьте, пожалуйста Li2O (валентность 2) Li3N (валентность 3) LiH(валентность 1) Cu2O (валентность 1) CuO(валентность 2) Правильно?

Составте химическии формулы соединении с помощью валентности а) оксидов, алюминия, кальция, серебра, б) хлоридо, железа[lll], натрия, бария?
Составте химическии формулы соединении с помощью валентности а) оксидов, алюминия, кальция, серебра, б) хлоридо, железа[lll], натрия, бария.
В) сульфидов, цинка, хрома[lll], калия.

1)На основании данных значений валентности выберите из списка веществ формулы оксидов которые составлены правильно?
1)На основании данных значений валентности выберите из списка веществ формулы оксидов которые составлены правильно.
(кислород проявляет валентность 2) 2)напишите уравнение химических реакций получения этих оксидов и дайте им названия : Na(валентность 1)O, Са(валентность 2) О, Мn(валентность 4)О4, С(валентность 4) О2, В2(валентность 3)О3, Si(валентность 4) О4,.
На этой странице сайта, в категории Химия размещен ответ на вопрос Какая валентность у серебра?. По уровню сложности вопрос рассчитан на учащихся 5 - 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Химия | 5 - 9 классы
Какая валентность у серебра?

У серебра валентность 1.
По таблице Менделеева смотри.
Поскольку этот элемент с постоянной валентностью, то смотри по номеру группы.
Серебро в первой группе, значит и валентность 1.

Составь формулы по валентности :P(валентность 5)ON(валентность 4)OS(валентность 4)OS(валентность 6)OC(валентность 4)OSi(валентность 4)OFe(валентность 3)OFe(валентность 2)OMg(валентность 2)O?
Составь формулы по валентности :

Срочно?
Даны оксиды CO ^ 2, H ^ 2O, SiO ^ 2.
Составьте формулы оксидов : S(ВАЛЕНТНОСТЬ 4), Cu(валентность 2), Fe(валентность 3), Hg( валентность 2), N(валентность 5), P( валентность 5), Se (валентность 6), Cl (валентность 7).
Составьте уравнения этих реакций.
Какие из них вступают в реакцию с водой?

Запишите уравнения реакции соединения с серой следующих металлов, зная, что валентность серы в этих соединениях равна II 1) Магния 2)Цинк 3)Серебро 4)Алюминий?
Запишите уравнения реакции соединения с серой следующих металлов, зная, что валентность серы в этих соединениях равна II 1) Магния 2)Цинк 3)Серебро 4)Алюминий.

Раствор серной кислоты реагирует с : 1)серебром 2)водородом 3)оксидом кремния(четырёх валентным) 4)оксидом меди(||)?
Раствор серной кислоты реагирует с : 1)серебром 2)водородом 3)оксидом кремния(четырёх валентным) 4)оксидом меди(||).

Как выводить формулу за валентностью и валентность за формулой ?
Как выводить формулу за валентностью и валентность за формулой ?

По обозначенной над символами химических элементов валентностью составьте соответствующие формулы соединений : Au(валентность 3)Cl, Cu(валентность 2)O, P(валентность 3)O, S(валентность 4)O, S(валентно?
По обозначенной над символами химических элементов валентностью составьте соответствующие формулы соединений : Au(валентность 3)Cl, Cu(валентность 2)O, P(валентность 3)O, S(валентность 4)O, S(валентность 6)O, Mn(валентность 4)O, P(валентность 3)H, Ni(валентность 2)O, B(валентность 3)O, Cd(валентность 2)O, W(валентность 6)O.

При взаимодействии чистого хлорида железа массой 100г с избытком нитрата серебра образовался хлорид серебра массой 265г хлорид железа 2 - х валентный или хлорид железа 3 - х валентный взят для реакции?
При взаимодействии чистого хлорида железа массой 100г с избытком нитрата серебра образовался хлорид серебра массой 265г хлорид железа 2 - х валентный или хлорид железа 3 - х валентный взят для реакции Полное решение пожалуйста).

Проверьте, пожалуйста Li2O (валентность 2) Li3N (валентность 3) LiH(валентность 1) Cu2O (валентность 1) CuO(валентность 2) Правильно?
Проверьте, пожалуйста Li2O (валентность 2) Li3N (валентность 3) LiH(валентность 1) Cu2O (валентность 1) CuO(валентность 2) Правильно?

Составте химическии формулы соединении с помощью валентности а) оксидов, алюминия, кальция, серебра, б) хлоридо, железа[lll], натрия, бария?
Составте химическии формулы соединении с помощью валентности а) оксидов, алюминия, кальция, серебра, б) хлоридо, железа[lll], натрия, бария.
В) сульфидов, цинка, хрома[lll], калия.

1)На основании данных значений валентности выберите из списка веществ формулы оксидов которые составлены правильно?
1)На основании данных значений валентности выберите из списка веществ формулы оксидов которые составлены правильно.
(кислород проявляет валентность 2) 2)напишите уравнение химических реакций получения этих оксидов и дайте им названия : Na(валентность 1)O, Са(валентность 2) О, Мn(валентность 4)О4, С(валентность 4) О2, В2(валентность 3)О3, Si(валентность 4) О4,.
На этой странице сайта, в категории Химия размещен ответ на вопрос Какая валентность у серебра?. По уровню сложности вопрос рассчитан на учащихся 5 - 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
Содержание
- 1 История возникновения понятия «валентность»
- 2 Современные представления о валентности
- 3 Примечания
- 4 См. также
- 5 Ссылки
- 6 Литература
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz ) [1] . В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества [2] .

Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт [3] . Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе» (соединительном весе), положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 году он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 году взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861-го, А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.

Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х годах появились первые молекулярные модели. Уже в 1864 году А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 году А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 году в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода — двум, азота — трём, углерода — четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода — двум, азота — трём, кремния — четырём, серы — шести.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду шести (SO3). Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность [некоторые элементы могут не иметь ни гидридов, ни оксидов]. Наприм., углерод образует с кислородом два оксида: монооксид углерода CO и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырём (некоторые элементы способны образовывать также пероксиды). Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом и/или методом, как правило, нельзя.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.

В основном, под валентностью химических элементов обычно понимается способность свободных его атомов (в более узком смысле — мера его способности) к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами [4] . При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бора, углерода и азота равна 4 (например, в [BF4] − , CH4 и [NH4] + ), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно-акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления (N2, NO2, NH3 и [NH4] + ).

Кроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов в ряде случаев можно выразить [часто и отождествить] иными способами: как, например, степень окисления элемента (условный заряд атома в предположении, что вещество состоит из ионов), ковалентность (число химических связей, образуемых атомом данного элемента, в том числе и с одноимённым элементом; см. ниже), координационное число атома (число атомов, непосредственно окружающих данный атом) и т. п. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу [5] . Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN − реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей [6] — нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи (чаще в таких случаях корректнее говорить о степени окисления). Представления о валентности не применимы для описания кластерных соединений, бороводородов, карборанов, π-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений с ионной кристаллической структурой. Так в кристалле хлорида натрия NaCl у каждого иона Na + или Cl − — центра элементарной ячейки — реальное число соседних ионов — координационное число — равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае [5] . В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому [7] .
Ковалентность элемента (мера валентных возможностей элементов; ёмкость насыщения) определяется общим числом неспаренных электронов [валентных электронных пар [8] ] как в нормальном, так и в возбуждённом состоянии атома, или, иначе говоря, число образуемых атомом ковалентных связей (углерод 2s 2 2p 2 II-ковалентен, а в возбуждённом состоянии C* 2s 1 2p 3 — IV-ковалентный; таким образом в CO и CO2 валентность составляет II или IV, а ковалентность — II и/или IV). Так, ковалентность азота в молекулах N2, NH3, Al≡N и цианамиде Ca=N-C≡N равна трём, ковалентность кислорода в молекулах H2O и CO2 — двум, ковалентность углерода в молекулах CH4, CO2 и кристалле C (алмаза) — четырём.
В классическом и/или пост-квантовохимическом представлении по электронным спектрам поглощения двухатомных молекул можно определять число оптических (валентных) электронов при данной энергии возбуждения [9] . Согласно этому методу, обратная величина тангенса угла наклона корреляционной прямой/прямых (при релевантных значениях молекулярных электронных термов, которые образованы относительными суммами атомных) соответствует числу пар валентных электронов, то есть валентности в её классическом понимании [10] .
Между валентностью [стехиометрической] в данном соединении, мольной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса».
Стехиометрическая валентность [расчётная] элемента в данном соединении [11] равна молекулярной массе его атомов (в г/моль), делённой на эквивалентную массу элемента (в г/моль):
V = M E <\displaystyle V=<\frac
V — Стехиометрическая валентность
M — Молекулярная масса (г/моль)
E — Эквивалентная масса (г/моль)
Так, стехиометрическая валентность углерода в CO 12 (г/моль) /6 (г/моль) = 2, а в CO2 12 /3 = 4.
В неорганической химии во многих случаях понятие валентности элемента теряет определённость: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы (таблицы ПСХЭ ). В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как большинство неорганических веществ имеет немолекулярное строение, а органических — молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин «валентные электроны», то есть наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
По валентности элементов можно составлять истинные формулы соединений, и, наоборот, исходя из истинных формул можно определять валентности элементов в данных соединениях. При этом необходимо придерживаться принципа, согласно которому произведение валентности одного элемента на число его атомов равно произведению валентности второго элемента на число его атомов. Так, чтобы составить формулу оксида азота (III), следует записать сверху над символом валентности элементов N I I I <\displaystyle <\stackrel
O I I <\displaystyle <\stackrel
. Определив наименьший общий знаменатель и разделив его на соответствующие валентности, получим атомное соотношение азота к кислороду, а именно 2 : 3. Следовательно, формула оксида азота (III) соответствует N + 3 2 O − 2 3 <\displaystyle <\stackrel <+3><\mbox
. Для определения валентности поступают таким же образом наоборот.
Читайте также:


