Как получить нитрат серебра
Опубликовано: 24.07.2024

20 мг/кг (собака, орально)
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
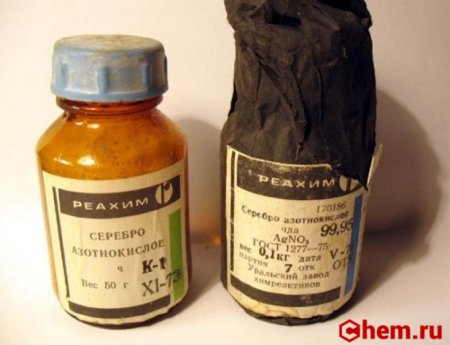
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O 
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓ 
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине


Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.

Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Для получения чистого драгоценного металла разработана технология его очистки от примесей. Она получила название аффинаж. Во время этой процедуры металл проходит несколько стадий обработки, в результате которых получается серебро, золото или платина заданной чистоты.

Очистка серебра считается промышленным процессом, но в настоящее время аффинаж белого металла можно провести и в домашних условиях. Как правило для очищения используется:
- ювелирный лом серебра;
- шламы от его электротехнической очистки;
- технологический серебросодержащий лом;
- “серебряная пена” из отходов свинцовых заводов.
Аффинаж состоит из трех частей: разбавление серебра в азотной кислоте, затвердевание металла и его сплавление и сама очистка электролизом (электролитическим способом).
Теперь обо всем по порядку.
Подручные инструменты и материалы
Чтобы провести аффинаж серебра дома и получить металл без примесей, необходимы небольшие познания в химии (на уровне средней школы), а также следующие материалы:
- азотная кислота 68,8%;
- деионизированная вода;
- стеклянная емкость;
- весы;
- кварцевая и латунная палочки;
- титановый тигль (емкость для сплавления);
- медные трубочки или любые другие медные изделия;
- фильтры для кофе;
- любой блок питания;
- пластиковая бутылка из под лимонада;
- вилка из нержавеющей стали и изолента;
- чайный фильтр;
- трубка для изоляции.
Растворение металла
Процесс начинается со смешивания кислоты и воды. Кислоту нужно разбавить водой в пропорции 1:1, размешать кварцевой палочкой и поместить в смесь серебро из расчета 50 г серебра на 1 л воды.
Внимание: кислота льется в воду, а не наоборот, кроме того, необходимо одеть перчатки и защитные очки. В ходе химической реакции раствор должен окраситься в голубой цвет. Процесс может занять время от несколько часов до суток. В результате вы получите нитрат серебра.
Рекомендуется проводить аффинаж на открытом воздухе или в хорошо проветриваемом помещении.
Цемент из серебра

Задачей следующего этапа станет получение металла из нитрата серебра. Для этого понадобится медь. Поскольку нитрат серебра имеет голубой оттенок, то в нем уже содержится медь. Чем раствор светлее, тем он лучше. В качестве источника меди можно взять обычные трубы. Подойдут старые водопроводные, только их нужно очистить от грязи и отложений.
Кусочки медных труб помещают в серебряный раствор. Медь служит катализатором и ускоряет процесс. Трубы быстро покрываются серебряным налетом – цементом. Периодически их нужно вынимать и стряхивать цемент в банку с раствором. Медные трубы постепенно растворяются, отдавая медь нитрату серебра. Если их недостаточно, следует добавить новые.
Трубы в таком положении можно оставить на 1-2 дня, периодически проверяя их и следя за тем, чтобы в емкость не попали посторонние предметы. Процесс завершается образованием осадка из серебряного цемента на дне емкости и прекращением реакции.
Раствор необходимо профильтровать. Для этого понадобится воронка и несколько фильтров для кофе. Промывание осадка нужно сделать не менее 5 раз чистой водой. Из остатков цемента выпаривается влага (можно подождать, пока она не испарится естественным способом).
Не торопитесь выбрасывать раствор после фильтрации: в нем еще есть серебро. Добавьте в него немного поваренной соли и оставьте в сторонке. Через некоторое время в емкости появится хлорид серебра.
Серебряный цемент, состоящий из крошек и пыли нужно собрать в единый кусок. Делается это при помощи его нагревания в тигле. Нагревать нужно равномерно и не спеша, иначе серебряная пыль будет разлетаться в разные стороны. Полученное на втором этапе в домашних условиях серебро, не является чистым, условно его можно обозначить 980 пробой. Брусок подвергнется дальнейшем очистке электролизом.
Серебро высшей пробы

В заключительной части аффинажа нужно соорудить электролитическую ванну. В качестве емкости подойдет дно от обрезанной лимонадной бутылки. Высота емкости должна быть такой, чтобы в нее вместилось не менее 1 литра раствора.
В чайный фильтр помещается брусок, полученный из серебряного цемента. Заранее к нему приваривается лента чистого серебра и цепляется посередине латунной палочки. На нее необходимо одеть изоляцию, так как она сыграет роль анода. Палочка продевается в края чайного фильтра и располагается над ванной.
Рукоятка вилки обматывается изолентой, а ее конец изгибается таким образом, чтобы вилку можно было подвесить на край ванночки. Получилась миниатюрная электролитическая емкость.
Раствор с нитратом серебра разбавляется дистиллированной водой в пропорции 1:1 и заливается в ванну. Жидкость не должна касаться места сцепления серебряного бруска и ленты, иначе металл растворится.
Вилка помещается в ванную, от блока питания к ней идет кабель “минус”, к латунной палочке – “плюс”. Следите за тем, чтобы напряжение тока было не более 4-8 W и мощность в 5 А.

Сразу же начинается реакция: стены ванночки покрываются кристаллами серебра, а брусок постепенно уменьшается. Чайный фильтр служит для сбора взвеси и мусора. Кристаллы не должны доходить до чайного пакетика, иначе произойдет короткое замыкание.
Раствор с электролитом убрать в емкость. Полученные кристаллы несколько раз нужно промыть в воде, высушить и сплавить в один кусок, как ранее это проделывалось с серебряным цементом.
Аффинаж завершен, в результате вы получили серебро 999 пробы, из которого можно делать оригинальные ювелирные украшения.

- Как получить нитрат серебра
- Как отделить серебро от меди
- Что такое ляпис
- - штатив;
- - пробирки;
- - концентрированная азотная кислота;
- - разбавленная азотная кислота;
- - оксид серебра;
- - сульфид серебра.
- нитрат серебра получение
- Серебро как химический элемент
- Как рассчитать титр
- Как сделать азотную кислоту
- Что такое серебро как химический элемент
![Что такое серебро как химический элемент]()
- Как получить серебро
![Как получить серебро]()
- К каким химическим элементам относится серебро
![К каким химическим элементам относится серебро]()
- Как изготовить селитру
![Как изготовить селитру]()
- Как распознать ортофосфорную кислоту
![Как распознать ортофосфорную кислоту]()
- Как распознать нитрат аммония
![Как распознать нитрат аммония]()
- Как сделать аммиачную селитру
![Как сделать аммиачную селитру]()
- Как определить хлорид натрия
![Как определить хлорид натрия]()
- Как определить раствор соляной кислоты
![Как определить раствор соляной кислоты]()
- Как отличить этаналь от этанола
- Как получить азотную кислоту
![Как получить азотную кислоту]()
- Что такое бертолетовая соль
- Как остановить кровь из носа
![Как остановить кровь из носа]()
- Как определить формальдегид
![Как определить формальдегид]()
- Как вычислить массу осадка
![Как вычислить массу осадка]()
- Как очистить серебро от примесей
![Как очистить серебро от примесей]()
- Как лечить экзему на лице
![Как лечить экзему на лице]()
- Как найти массу осадка в растворе
![Как найти массу осадка в растворе]()
- Как определить состав воды
![Как определить состав воды]()
- Как восстановить цветы после нашествия кошки
![Как восстановить цветы после нашествия кошки]()





ПОЛУЧЕНИЕ НИТРАТА СЕРЕБРА ИЗ ВТОРИЧНОГО СЫРЬЯ
- Авторы
- Руководители
- Файлы работы
- Наградные документы

Автор работы награжден дипломом победителя II степени
В настоящее время в современных школах (особенно в сельских и деревенских) существует проблема заказа и доставки химических реактивов. Одним из наиболее дорогостоящих и используемых в школьном химическом практикуме является нитрат серебра (I). Стоимость его за 1 г составляет от 25 до 45 рублей. Цена колеблется в зависимости от изготовителя и удалённости фирмы производителя от заказчиков.
Нитрат серебра (I) в школьном химическом практикуме используется при проведении ярких качественных реакций в неорганической и органической химии [1]. Поэтому отсутствие его в школьной лаборатории – это огромный минус «химической наглядности».
Таким образом, целью работы являлось получение нитрата серебра (I) в условиях школьной лаборатории.
Где же взять такой драгоценный металл как серебро?! Известно, что серебро содержится в рентгеновских снимках, проявленных фотоплёнках, в фотографиях [2]. Именно из них, в несколько стадий, был получен нитрат серебра (I).
1. Используя литературные источники, определить вторичное сырье для получения нитрата серебра
2. Получить нитрат серебра из различных объектов
3. Сравнить выход продуктов реакции
4. Провести качественные реакции с полученным в условиях школьной лаборатории нитратом серебра (I).
Глава I. Литературный обзор
1. 1 Серебро и его свойства
Серебро стало известно значительно позднее золота, хотя так же встречается в самородном состоянии. В Египте археологами найдены серебреные украшения, относящиеся ещё к додинастическому периоду (5000 – 3400 до н. э.). Однако долгое время серебро было большой редкостью и ценилось дороже золота.
Чистое серебро не темнеет на воздухе, а вот серебро с примесью может достаточно быстро потемнеть (рис. 1) [2].
Рис. 1. Серебреное изделие из ювелирного магазина (А) и после некоторого ношения человеком (Б).
Потемнение указывает на наличие серы в воздухе, например, при загрязнении воздуха или болезни обладателя серебреного предмета. После золота серебро является самым лёгким по обработке металлом. Из 30 граммов серебра можно вытянуть проволоку длиной более 50 км. Это также самый лучший из известных проводников тепла и электроэнергии [4].
Соединения серебра часто не устойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Ещё в середине 20 века почти половина всего добытого серебра шла на изготовление кино- и фотоматериалов. Одним из соединений серебра является ляпис [5].
1.2 Применение нитрата серебра в медицине
Нитрат серебра, ляпис (AgNO3) − бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра (рис. 2) [3].
Рис. 2. Внешний вид нитрата серебра
Впервые ляпис был применён в XVII веке врачами-алхимиками: голландец Ян-Батист Ван Гельмонт и немец Франциск де ла Бое Сильвий. Они научились получать нитрат серебра взаимодействием металла с азотной кислотой. Учёные обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте – глубоких ожогов (рис. 3). Поэтому это вещество прозвали «адским камнем».
Рис. 3. Образование чёрных пятен при прикосновении к нитрату серебра.
Адский камень – не чистый нитрат серебра, а его сплав с нитратом калия, иногда отливается в виде палочек – ляписного карандаша. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство.
Фармакологическое действие - антисептическое, вяжущее, противовоспалительное, прижигающее, противомикробное, бактерицидное. Связывает сульфгидрильные и карбоксильные группы, что может обусловливать изменение конформации белка, его структуры, или вызывать денатурацию. При диссоциации нитрата серебра ионы серебра вызывают преципитацию белков и обусловливают бактерицидное действие. Альбуминат серебра, образующийся при взаимодействии нитрата серебра с тканевыми белками, постепенно приобретает черную окраску (это связано с восстановлением из альбумината металлического серебра), что, в свою очередь, приводит к взаимодействию с активными группами ферментов. Блокирует некоторые ферментные системы, нарушая тем самым метаболические процессы в микробной клетке. В связи с этим нитрат серебра после кратковременного бактерицидного оказывает длительное бактериостатическое действие. Серебра нитрат при разведении 1:1000 уничтожает большинство микроорганизмов.
Ранее серебра нитрат применяли при хроническом гастрите и язвенной болезни желудка и двенадцатиперстной кишки (внутрь, в виде 0,05% раствора). Раствор (2%) может использоваться для профилактики гонококковой инфекции глаз у новорожденных [2].
1.3 Вторичное серебросодержащее сырьё
Основными поставщиками серебросодержащего сырья являются химическая, радио- и электротехническая промышленности; производства: ювелирное, часовое и зеркальное, а также рентгеновские кабинеты в медицинских поликлиниках.
Серебросодержащие отходы фото- и кинопромышленности образуются в процессе изготовления, обработки и порчи светочувствительных материалов или износа кинолент и фотоотпечатков.
Отходы химической промышленности поступают в виде отработанных контактных масс (20-80% Ag); отработанных катализаторов (более 80% Ag); шламов (от 60 до 80% Ag); лома серебряной аппаратуры (20-25% Ag).
Образование серебросодержащих отходов в зеркальной промышленности происходит в процессе серебрения зеркал, елочных украшений и так далее [3].
Часовое производство направляет на переработку следующие виды сырья, содержащего Ag, %: серебряные припои - от 15 до 99; серебряные контакты 20-80; опилки и стружку - от 10 до 70.
От лечебных учреждений на извлечение серебра поступают, %: зола рентгенопленки и фотоотпечатков - от 0,5 до 50; сернистое серебро 45-65.
Большое количество серебросодержащего сырья (до 30-40% Ag) перерабатывается в виде отходов электронной и электротехнической отраслей промышленности: вышедшие из строя серебряно-цинковые и серебряно-кадмиевые аккумуляторы (от 30 до 60%); сплавы-контакты, серебряные припои (от 5 до 99%); металлокерамические композиции 25-50.
Кроме перечисленных отходов на переработку поступают другие виды сырья, резко различающиеся химическими и физическими свойствами.
Глава II. Объекты и методы исследования
2.1 Объекты исследования
В качестве объектов исследования для получения реактива нитрата серебра были использованы рентгеновские снимки, фотоплёнка, ёлочная игрушка, зеркало (рис. 4).
Рис. 4. Вторичное серебросодержащее сырьё:
А. Рентгеновские снимки. Б. Фотоплёнка.
2.2 Методика получения нитрата серебра из рентгеновских снимков и фотоплёнок
Рентгеновские снимки и фотоплёнку резали на мелкие кусочки и отмеряли на весах по 17 граммов каждого. Далее подготовленный материал растворяли в азотной кислоте (концентрированной) (рис. 5).
Рис. 5. Растворение рентгеновских снимков в азотной кислоте.
После растворения объектов приливали раствор поваренной соли. Полученный осадок промывали водой и заливали раствором хлороводородной кислоты. После чего в осадок клали гранулы цинка для проведения реакции замещения. По завершении реакции, полученный порошок промывали и высушивали. Высушенное серебро растворяли в растворе азотной кислоты, затем выпаривали и растворяли в дистиллированной воде [1].
2.3 Методика получения нитрата серебра из серебросодержащих изделий
Ёлочную игрушку и зеркало очищали от различного рода загрязнений и заливали раствором азотной кислоты до растворения (рис. 6). Полученный раствор выпаривали и получали порошок, который прокаливали в фарфоровой чашке. К остуженному расплаву приливали воды, и полученный раствор нитрата серебра сливали.
Рис. 6. Растворение ёлочной игрушки в растворе азотной кислоты.
2.4 Методика проведения качественных реакций на галогенид-ионы
К растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы приливали раствор полученного нитрата серебра. Наблюдали выпадение осадков.
2.5 Методика проведения реакции «серебряного зеркала»
К раствору аммиачного нитрата серебра добавляли примерно столько же глюкозы и нагревали содержимое пробирки до образования осадка на стенках.
Глава III. Результаты и их обсуждение
3.1 Результаты получения нитрата серебра из рентгеновских снимков и фотоплёнок
После добавления концентрированной азотной кислоты ионы серебра выделились в раствор. Далее при приливании к полученному раствору хлорида натрия происходило образование белого осадка (1) (рис. 7):
Ag + + NaCl → AgCl↓ + Na + (1).
Рис. 7. Образование белого осадка хлорида серебра.
После окончательного промывания и осаждения хлорида серебра к осадку с соляной кислотой добавляли гранулы цинка, что способствовало образованию серебра (2):
2AgCl↓ + Zn → ZnCl2 + 2Ag↓ (2)
После добавления к образовавшемуся серебру разбавленной азотной кислоты происходило образование нитрата серебра и выделение газа (3):
После выпаривания нитрата серебра, в случае с рентгеновской плёнкой его масса составила 1,2 грамма. В случае с фотоплёнкой масса нитрата серебра составила 0,8 граммов.
3.2 Результаты получения нитрата серебра из серебросодержащих изделий
Содержащееся на поверхности изделий серебро растворилось в растворе азотной кислоты полностью: от зеркала осталось прозрачное стекло. Теперь в растворе находятся соли серебра и меди. Чтобы избавиться от примеси солей меди, раствор выпарили и прокалили до образования оксида меди (II) (4) (рис. 8):
Рис. 11. Выпаривание раствора солей серебра и меди.
После приливали воду, нитрат серебра растворялся, а оксид меди оставался в виде осадка. Полученный раствор слили в склянку с надписью AgNO3.
3.3 Результаты проведения качественных реакций на галогенид-ионы с полученным нитратом серебра
После приливания нитрата серебра к растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы происходило образование белого (5), светло-жёлтого (6) и жёлтого осадков (7) соответственно (рис. 9):
Рис. 9. Качественные реакции на галогенид-ионы. А. Хлорид-ионы. Б. Бромид-ионы. В. Иодид-ионы
3.4 Результаты проведения реакции «серебряного зеркала»
После добавления к аммиачному раствору серебра глюкозы и нагревании смеси, произошло выпадение осадка серебра на стенках пробирки (8):
Это свидетельствует о том, что в ходе исследования действительно был получен нитрат серебра.
ВЫВОДЫ
1. Исходя из литературных источников, сырьём для получения нитрата серебра являются рентгеновские снимки, фотоплёнки, ёлочные игрушки, зеркала.
2. Чистый нитрат серебра был получен из рентгеновских снимков и фотоплёнок.
3. Выход нитрата серебра, полученного из рентгеновских снимков оказался больше, чем при получении из фотоплёнок.
4. Были проведены качественные реакции с помощью полученного нитрата серебра.
5. При острой необходимости, нитрат серебра можно получить в школьной лаборатории.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Мосина Т. А. Нитрат серебра для ретро // Сделай сам. – 1990. - №4. С.141
2. Польза серебра для здоровья [Электронный ресурс]. – Лаборатория омоложения – Режим доступа: http://www.deus1.com/serebro.html
3. Серебряные лекарства [Электронный ресурс]. – Аптечные сторожилы. - Режим доступа: http://www.alhimik.ru/apteka/apt2N-Ag.html#4.31
4. Харитонов Ю. Я. Аналитическая химия. – М.: Высшая школа, 2001.
Читайте также: