Как из золота получить оксид золота 3
Опубликовано: 24.07.2024
| Оксид золота(III) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид золота(III) |
| Традиционные названия | Окись золота |
| Химическая формула | Au2O3 |
| Эмпирическая формула | Au2O3 |
| Физические свойства | |
| Состояние (ст. усл.) | красно-бурый порошок |
| Молярная масса | 441,93 г/моль |
| Плотность | 10,38 г/см³ |
| Термические свойства | |
| Химические свойства | |
| Растворимость в воде | не раств. |
| Классификация | |
| Рег. номер CAS | 1303-58-8 |
Окси́д зо́лота(III) — бинарное неорганическое химическое соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота.
Получение
Получается из гидроксида золота(III) Au2O3 x H2O обезвоживанием при нагревании. Полная потеря воды наступает при температуре около 200 о С. [1] . Полученный таким образом оксид золота(III) аморфен. Имеет красный или красно-бурый цвет. Примесь бурого, как и в случае гидроксида золота(III), обычно связывают с присутствием небольшого количества золота(0). Монокристаллы Au2O3 были получены из аморфного оксида гидротермальным синтезом в кварцевой ампуле, заполненной на треть смесью хлорной кислоты HClO4 и перхлората щелочного металла (температура синтеза 235—275 о С, давление до 30 МРа). Полученные монокристаллы имели рубиново-красный цвет [1] .
Свойства
Структура кристаллического Au2O3 орторомбическая, группа Fdd2. Атомы золота имеют тетрагональную (близкую к квадратной) координацию атомами кислорода со средним расстоянием Au-O 2,02—2,03 А. Часть атомов кислорода являются мостиковыми — одни связаны с двумя атомами золота, другие с тремя [2] [3] .
По данным кристаллографии, плотность равна 10,38 г / см 3 .
Нагрев аморфного оксида золота(III) до 260—300 о С приводит к полному разложению с выделением кислорода и металлического золота [1] , хотя разложение начинается уже при более низкой температуре.
Оксид золота(III) нерастворим в воде. Заметно, хотя и медленно, растворяется в растворах щелочей, образуя тетрагидроксокомплекс Au(OH)4 - . Встречающиеся указания на амфотерность требуют уточнения. Поскольку золото(III) никогда не образует в растворе простых солей с катионом Au 3+ , а получаются только комплексные формы, то растворимость Au2O3 в некоторых кислотах обусловлена не только взаимодействием с H + , но в первую очередь именно комплексообразованием с анионом кислоты. Так, оксид золота(III) хорошо растворяется в соляной кислоте, давая HAuCl4. Умеренно растворим в азотной и серной кислотах, давая смешанные аквагидроксонитратные или аквагидроксосульфатные комплексы типа Au(OH)i(H2O)jXk z (где i + j + k = 4, X = NO3 или SO4, z = -i + kzX). Нерастворим в хлорной кислоте любой концентрации.
Оксид золота в виде пленки на инертной подложке испытывался для получения токопроводящих соединений («золотых дорожек») в микроэлектронике. Пленки получали магнетронным напылением, разложение оксида до золота в нужных местах проводили при помощи лазера [4]
Читайте в этой статье:
Оксид золота — это химическое соединение, в котором задействованы кислород и золото. Как известно, Au относят к благородным металлам, элемент характеризуется таким образом потому, что он не вступает в контакт с реагентами. Кислород, вода, кислоты и щелочи никаким образом не способны навредить золоту и еще шести металлам платиновой группы. Так как же получить химическое соединение кислорода с золотом, если металл инертен?
Оксиды и их свойства
Оксид золота в природе не образуется, элементы, с которыми соединяется этот металл, можно пересчитать по пальцам. Их крайне мало. Если говорить о чистом золоте, то кислород его не разрушает, то же самое можно сказать о воде и большом количестве других реагентов.

Химический элемент золото
Золото окисляется только при взаимодействии со следующими элементами:
- ртутью;
- смесью соляной и азотной кислот;
- селеновой кислотой;
- хлором и бромом.
Если говорить о ртути, то при взаимодействии элементов образуется сплав, который химики называют амальгамой.
Смесь азотной и соляной кислот в пропорции 1 к 3 называют царской водкой, при погружении в эту смесь металл начинает растворяться. При повышении температуры реакция ускоряется.
Селеновая кислота в высокой концентрации способна окислить золота, подобная технология применяется только в промышленности, для извлечения благородного элемента из породы.
Хлор и бром могут взаимодействовать с Au, присутствие хлора в реакции ускоряет процесс. По этой причине не рекомендуется надевать золотые украшения во время уборки, им может быть нанесен вред.
Оксид золота имеет несколько разновидностей, также существует и гидроксид, который является смесью золота, кислорода и водорода. Если говорить проще, это смесь воды и благородного металла. Но поскольку металл инертен, получить такую смесь не так просто.
Чистое золото окисляться может только при определенных обстоятельствах. Для этого необходимо поддержание температурного режима и соблюдение условий.
Оксид золота бывает всего двух разновидностей, определить, о каком именно химическом элементе идет речь, можно при помощи обозначения. Химики дополняют название веществ римскими цифрами I и III.
Элемент представляет собой неорганическое соединение, окись металла и кислорода, рассматривается как соль аурат или окисел смешанного типа. Представляет собой порошок коричневого цвета.
Окись золота можно получить несколькими способами, но в реакции обязательно должен участвовать кислород.
Соединение воды и Au под номером I получают путем нагревания элемента с аналогичным названием, но под номером III. А для получения оксида понадобится гидроксид, то есть соединение металла с водой.

Химическое соединение Au2O3
- имеет химическую формулу Au2O3;
- отличается устойчивостью;
- получают путем обезвоживания при нагревании;
- элемент аморфен;
- имеет красный или бурый оттенок.
Реакция проходит в ампуле из кварца, которая на одну треть должна быть заполнена хлорной кислотой, при температуре в 200 градусов. Из соединения путем повышения температуры испаряют воду, в результате получают порошок красного или бурого оттенка. Бурый оттенок свидетельствует или о низком качестве металла, или его небольшом содержании.
При повышении температуры можно получить кристаллы, которые будут иметь рубиновый оттенок. Показатели должны быть примерно 240–270 градусов.
Можно характеризовать соединение под номером III следующими свойствами:
- Не растворяется в воде.
- Плотность элемента составляет 10,38 г на куб. см.
- Если нагреть элемент до 300 градусов, то пойдет реакция с полным разложением.
- Растворяется в щелочах, но реакция идет медленно.
Кристаллы соединяются друг с другом по типу мостика, то есть одна молекула цепляет две, две молекулы цепляют три и таким образом — по восходящей.
Можно заметить, что оксид имеет определенное сходство с металлом, например, элемент так же ускоренно растворяется в соляной и азотной кислотах.
Что может элемент под номером I и какими обладает свойствами:
- имеет химическую формулу Au2O (две молекулы золота присоединяют одну молекулу кислорода);
- выглядит как порошок синего цвета;
- соединение неустойчивое;
- может находиться в виде гидрозоля.
Получают элемент при нагревании, для проведения реакции понадобятся гидроксид калия и хлорид золота.
Соединение быстро возвращается в первоначальное состояние, по этой причине элемент рассматривают как порошок, который может иметь фиолетовый оттенок. При повышении температуры соединение разлагается.
Если добавить в соединение гидроксид аммония, или, говоря проще, нашатырь, то в процессе реакции образуется осадок черного цвета. При силовом воздействии (от удара) соединение может взорваться.
Соединение с химической формулой 3Au2O·4NH3, не отличается устойчивостью, распадается в горячей воде, не образует осадка.
Почему происходит окисление?
Окисление может происходить по нескольким причинам; если говорить об обычных металлах, то они взаимодействуют с кислородом и водой, также на элементы могут воздействовать реагенты: щелочи и кислоты. Если реакция проходит в лабораторных условиях, то реагенты используют с определенной целью. В домашних условиях столкнуться со щелочами и кислотами можно при выполнении работ по дому, поскольку большое количество средств для уборки состоит из химических соединений, в состав которых входят либо щелочи, либо кислоты.
Если говорить о чистом золоте и металлах платиновой группы, то они к окислению несвойственны, подобная реакция возможна только в условиях лабораторий с использованием определенных реагентов, которых не так много.
Золото в украшениях может окисляться по причине того, что в состав изделий входят и другие материалы. Сплав готовят из нескольких элементов, разбавляя благородный металл латунью, никелем или медью. Эти элементы не столь устойчивы к факторам внешней среды и реагентам, из-за чего на поверхности драгоценностей и образуется налет. По этой причине стоит беречь украшения и правильно ухаживать за ними. Чем больше в сплаве лигатуры и других примесей помимо золота, тем сильнее оно подвержено коррозии.
Учитывая все свойства золота и характеристики, получение оксида этого металла — это трудоемкий процесс, провести который можно только в лабораторных условиях. Провести процедуру дома, без наличия оснащения невозможно.
Не так давно ученым удалось исполнить мечту всех алхимиков и получить Au из ртути, соединение получилось устойчивым. Но искусственный металл и его производство было признано неперспективным.
Возможно, в скором времени, химики удивят еще чем-нибудь и научатся добывать или синтезировать благородный металл в промышленном масштабе.
Бытует мнение, что золото, являясь благородным металлом, не реагирует с другими веществами и потому не образует соединений. На самом деле все немного не так. Химикам известно немало соединений этого драгоценного металла, среди них и оксид золота. В зависимости от того, какой валентностью обладает атом золота в веществе, существуют соединения одно-, двух-, трехвалентного золота.

К первой группе относят цианид, иодид, бромид, хлорид, гидрид золота. Вещества, в которых золото имеет валентность ІІ, обладают малой устойчивостью и могут существовать лишь в лаборатории. Трехвалентный аурум входит в состав гидроксида, димера бромида, а также оксида золота. Существует два оксида золота с валентностью І и ІІІ соответственно. Несмотря на то, что два этих вещества построены из одних и тех же атомов и отличаются лишь их количеством, они обладают разными свойствами и даже выглядят по-разному.
Золота оксид (І)
Является бинарным, то есть состоящим всего из двух видов атомов, соединением с химической формулой Au2O. Представляет собой порошок серо-фиолетового цвета или же синий гидрозоль. В воде он не растворяется, но пребывание во влажной среде ведет к превращению в другое вещество. Если же нагреть окись золота примерно до 200 градусов Цельсия, то произойдет разложение на составляющие его элементы. Низкая термическая резистентность обусловлена тем, что ионы золота обладают окислительной способностью и сильным поляризующим действиям.
Получить оксид одновалентного золота сложно, ведь золото окисляется очень плохо. Учитывая тот факт, что золото — это очень инертный элемент, простая реакция с кислородом даже при высокой температуре не приведет к образованию оксида, как это происходит с большинством других легко окисляющихся металлов. Даже пропуская электрический ток через электрод из золота, все равно не добиться получения на его поверхности пленки из оксида. Для того чтобы синтезировать оксид золота, используют двухэтапную методику. Сначала к холодному водному раствору щелочи добавляют хлорид золота и затем полученную смесь постепенно нагревают.
Что же касается химических свойств данного вещества, то оно способно реагировать с концентрированным гидроксидом аммония. При этом образуется сложное неорганическое соединение в виде черного осадка, который обладает способностью взрываться при ударах.
Оксид трехвалентного золота
Другое бинарное соединение золота состоит из двух атомов Au и трех атомов кислорода, что можно записать: Au2O3. Представляет собой твердое коричневое вещество, которое легко поддается распаду даже под воздействием солнечного света. Оксид золота (ІІІ) не может быть растворен в воде, однако хорошо растворяется в гидроксиде калия, образуя сложное комплексное соединение. Получают путем просушки гидроксида золота над парами оксида фосфора с дальнейшим нагреванием смеси до 140 градусов. Соблюдение правильного режима температур критически важно, ведь если разогреть реагенты на дополнительных 20 градусов, то вместо обезвоживания гидроокиси и кристаллизации оксида произойдет разложение выходящей смеси.
Исходя из химических свойств вещества, его также называют золотой кислотой, ведь Au2O3 может образовывать соли, называемые ауратами. Благодаря своим свойствам оксид золота (ІІІ) нашел свое применение в технике. Именно из него делали «золотые дорожки» на микроэлектронных платах, нанося на поверхность слой вещества, а затем воздействуя на него лазером, чтобы получить тонкую полоску из благородного металла.
Существует еще одно вещество, которое может быть отнесено к оксидам золота. Это соединение, в котором присутствуют атомы с валентностями I и III одновременно. По сути, это смесь обоих оксидов, вещество существует в виде коричневого порошка, который сильно впитывает влагу.
Общим для всех оксидов золота является то, что они почти не находят применения в технике или любой другой отрасли промышленности. Причина этого, по всей видимости, в том, что данные соединения неустойчивы в условиях внешней среды и легко разрушаются, переходя в другие вещества. А также не стоит забывать о высокой цене самого золота, не говоря уже о дополнительных затратах на реакции, необходимые для того, чтобы заставить его окисляться. Поэтому сейчас с оксидами золота дело имеют преимущественно химики-теоретики, проводя с ними множество экспериментов. Но вполне может быть, что скоро они увенчаются успехом, и материалы на основе оксида золота помогут сделать очередной технологический прорыв.
оксид золота (III) неорганическое соединение, химическая формула которого Au2О3. Теоретически можно ожидать, что его природа будет ковалентного типа. Однако наличие определенного ионного характера в его твердом теле не может быть полностью исключено; или что то же самое, предположим, что отсутствие катиона 3+ рядом с анионом O 2- .
Может показаться противоречивым, что золото, будучи благородным металлом, может ржаветь. При нормальных условиях кусочки золота (как звезды на изображении ниже) не могут окисляться при контакте с кислородом в атмосфере; однако при облучении ультрафиолетовым излучением в присутствии озона ИЛИ3, картина отличается.

Если бы золотые звезды подвергались этим условиям, они бы стали красновато-коричневыми, характерными для Au.2О3.
Другие способы получения этого оксида будут включать химическую обработку указанных звезд; например, преобразование массы золота в соответствующий хлорид, AuCl3.
После, к AuCl3, и остальная часть возможных образованных солей золота добавляют сильную основную среду; и с этим, вы получите гидратированный оксид или гидроксид, Au (OH)3. Наконец, это последнее соединение термически дегидратируется для получения Au.2О3.
- 1 Структура оксида золота (III)
- 1.1 Электронные аспекты
- 1.2 Гидраты
- 2 свойства
- 2.1 Внешний вид
- 2.2 Молекулярная масса
- 2.3 Плотность
- 2.4 Точка плавления
- 2.5 Стабильность
- 2.6 Растворимость
- 3 Номенклатура
- 4 использования
- 4.1 Окраска очков
- 4.2 Синтез ауратов и молниеносного золота
- 4.3 Обработка самосборных монослоев
- 5 ссылок
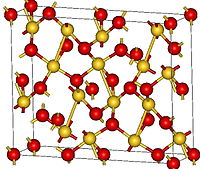
Структура оксида золота (III)

Кристаллическая структура оксида золота (III) показана на верхнем изображении. Расположение атомов золота и кислорода в твердом теле показано либо в виде нейтральных атомов (ковалентное твердое вещество), либо в виде ионов (ионное твердое тело). Нечетко, достаточно в любом случае устранить или разместить ссылки Au-O.
Согласно изображению предполагается, что преобладает ковалентный характер (что было бы логично). По этой причине представленные атомы и связи показаны со сферами и столбцами, соответственно. Золотые сферы соответствуют атомам золота (Au III -О) и красноватые до атомов кислорода.
Если вы посмотрите внимательно, вы увидите, что есть единицы AuO4, которые соединены атомами кислорода. Другим способом визуализации было бы учесть, что каждый Au 3+ окружен четырьмя O 2- ; Конечно, с ионной точки зрения.
Эта структура является кристаллической, потому что атомы упорядочены, следуя той же схеме дальнего действия. Таким образом, его унитарная ячейка соответствует ромбоэдрической кристаллической системе (так же, как на верхнем изображении). Поэтому все Au2О3 может быть построен, если бы все эти сферы элементарной ячейки были распределены в пространстве.
Электронные аспекты
Золото является переходным металлом, и следует ожидать, что его 5d-орбитали взаимодействуют непосредственно с 2p-орбиталями атома кислорода. Это перекрытие их орбиталей теоретически должно генерировать зоны проводимости, которые бы преобразовывали Au2О3 в твердом полупроводнике.
Таким образом, истинная структура Au2О3 еще сложнее с этим в виду.
гидраты
Оксид золота может удерживать молекулы воды в своих ромбоэдрических кристаллах, что приводит к образованию гидратов. Когда образуются такие гидраты, структура становится аморфной, то есть неупорядоченной.
Химическая формула для таких гидратов может быть любой из следующих, которые на самом деле не уточнены: Au2О3∙ ж2O (z = 1, 2, 3 и т. Д.), Au (OH)3, или AuхОи(ОН)Z.
Формула Au (OH)3 представляет чрезмерное упрощение истинного состава указанных гидратов. Это связано с тем, что в гидроксиде золота (III) исследователи также обнаружили присутствие Au2О3; и поэтому имеет смысл рассматривать его изолированно как «простой» гидроксид переходного металла.
С другой стороны, твердого тела с формулой AuхОи(ОН)Z можно ожидать аморфную структуру; так как это зависит от коэффициентов х, и и Z, чьи вариации породили бы все виды структур, которые едва ли могли бы иметь кристаллическую структуру.
свойства
Внешний вид
Это красновато-коричневое твердое вещество.
Молекулярная масса
плотность
Точка плавления
Тает и разлагается при 160ºC. Поэтому ему не хватает температуры кипения, поэтому этот оксид никогда не достигает температуры кипения.
стабильность
Au2О3 оно термодинамически нестабильно, потому что, как упоминалось в начале, золото не склонно окисляться при нормальных температурных условиях. Так что его легко уменьшить, чтобы снова стать благородным золотом.
Чем выше температура, тем быстрее протекает реакция, известная как термическое разложение. Итак, Au2О3 при 160 ° C он разлагается, образуя металлическое золото и выделяя молекулярный кислород:
Очень похожая реакция может происходить с другими соединениями, которые способствуют указанному восстановлению. Почему сокращение? Потому что золото возвращается, чтобы получить электроны, которые кислород забрал у него; это то же самое, что сказать, что он теряет связь с кислородом.
растворимость
Это твердое вещество, нерастворимое в воде. Однако он растворим в соляной кислоте и азотной кислоте из-за образования хлоридов и нитратов золота.
номенклатура
Оксид золота (III) - это название, определяемое номенклатурой запасов. Другие способы упомянуть это:
-Традиционная номенклатура: оксид аурика, потому что валентность 3+ является самой высокой для золота.
-Систематическая номенклатура: диоксид триоксида.
приложений
Окраска очков
Одним из наиболее выдающихся применений является придание красноватых цветов некоторым материалам, таким как стекла, в дополнение к приданию определенных свойств, присущих атомам золота..
Синтез ауратов и молниеносного золота
Если Au добавлен2О3 в среду, где он растворим, и в присутствии металлов аураты могут выпадать в осадок после добавления сильного основания; которые образованы анионами AuO4 - в компании металлических катионов.
Кроме того, Au2О3 реагирует с аммиаком с образованием молниеносного соединения золота, Au2О3(NH3)4. Его название происходит от того факта, что он очень взрывоопасен.
Обработка самосборных монослоев
Что касается золота и его оксида, некоторые соединения, такие как диалкилдисульфиды, RSSR, не адсорбируются одинаково. Когда происходит эта адсорбция, спонтанно образуется связь Au-S, где атом серы проявляет и определяет химические характеристики указанной поверхности в зависимости от функциональной группы, с которой она связана..
RSSR не может адсорбироваться на Au2О3, но на металлическом золоте. Поэтому, если поверхность золота и его степень окисления модифицируются, а также размер частиц или слоев Au2О3, может быть разработана более неоднородная поверхность.
Это поверхность ау2О3-AuSR взаимодействует с оксидами металлов некоторых электронных устройств, тем самым создавая в будущем более умные поверхности.
Добрый день, дорогой читатель! Давайте сегодня поговорим о том, что такое аффинаж золота, почему существует столько технологий аффинажа и какую пользу он приносит.
Золотой резерв России на начало осени 2018 года составил 1968 т. Всё это — золото очень высокой пробы, практически чистое, — в природе такое не встречается. Основной продукт добычи — не крупные самородки, а кварцевые жилы, сплавы и вымываемый водами песок (вторичные месторождения). Чтобы крупицы драгоценного металла превратились в слиток, они должны пройти целый цикл обработки.
Что такое аффинаж и зачем он нужен
Аффинаж — это процесс глубокой очистки металла от примесей, то есть повышение пробы. Его методики основаны на различиях в химических и физических свойствах металлов, присутствующих в сплаве. Золото — инертный металл (почти не реагирует с кислотами и не образует оксидов), и это упрощает процесс его выделения из полуфабриката.

Аффинируют сплавы, полученные из разных источников и обладающие разной степенью чистоты:
- золотосодержащие смеси веществ, добытые в природе;
- золотой лом (технический, ювелирный, бытовой);
- шлам, оставшийся после очистки меди, серебра, цинка (в нашем случае — после электролиза);
- отходы свинцового производства — «серебристая» (цинковая) пена с примесями благородных металлов;
- золотосодержащий электронный мусор (микросхемы, карты памяти, транзисторы).
Наибольшая доля сырья, поступающая в аффинажную обработку, — это так называемое «черновое золото» — продукция предприятий, занимающихся золотодобычей и первичной переработкой руды. Черновой металл представлен главным образом шлиховым золотом (россыпью) и шламом, реже природными слитками.
Юридические аспекты
Государство контролирует сделки с драгоценными металлами, камнями и жемчугом, а их нелегальный оборот расценивается как угроза экономической безопасности. Статья 191 УК РФ предусматривает для граждан ответственность за незаконные действия:
- покупку или продажу;
- хранение;
- транспортировку (перевозку, пересылку).
Где можно провести процедуру
- Аффинированием золота занимаются специализированные предприятия. В России это АО «Уралэлектромедь», Колымский аффинажный завод, ООО «Красцветмет» и ещё несколько организаций. Основной способ очистки металла от примесей в промышленных масштабах — электролитический (разделение расплава на составные части посредством пропускания через него электрического тока).
- Существуют лаборатории, располагающие нужным оборудованием и вытяжкой.
- Некоторые техники аффинажа можно воспроизвести в домашних условиях, если позаботиться о материалах и инструментах.
Способы аффинажа золота
Методы очистки благородных металлов делятся на:
- химические (построенные на взаимодействии веществ, бывают сухими и мокрыми);
- электрохимические (электролиз).
Сухие
Говоря о сухом методе очистки золота, имеют в виду метод Миллера. Он применяется только в промышленных условиях из-за токсичности и коррозионной активности хлора и его соединений, которые в избытке выделяются при проведении реакции.

Суть способа: через измельчённую массу обрабатываемого вещества пропускается газообразный хлор. Соединения неблагородных металлов с хлором летучи и удаляются из сплава, повышая пробу золота.
Метод Миллера эффективен за счёт того, что благородные металлы реагируют с хлором в последнюю очередь (первыми выводятся цинк и железо, последними — золото и платина). Его преимущества:
- он недорог;
- не требует больших площадей для размещения оборудования;
- недолог — занимает несколько часов;
- удаляет почти всю лигатуру, повышая содержание золота в сплаве до 99,5–99,9 %.
Процесс аффинажа происходит в тигле (огнеупорной плавильной ёмкости), куда через трубу поступает хлор. Лишние компоненты удаляются из смеси, а хлорид серебра поднимается на поверхность сплава — это позволяет дополнительно отделить друг от друга благородные металлы. Метод Миллера помогает получить золото и из многокомпонентного сплава, и из сплава с серебром.
Мокрые
Отделять благородный металл от лигатуры удобно растворением либо самого металла, либо примесей.
Самый популярный метод аффинажа заключается во взаимодействии лома с царской водкой (смесью азотной и соляной кислот — одним из немногих составов, растворяющих золото). Раствор подвергается выпариванию, а золото осаждается с помощью железного купороса (он также подходит для восстановления из хлорида), щавелевой кислоты, пиросульфита натрия или гидразина.
Если реакция восстановления проведена правильно, потери чистого вещества на выходе будут минимальными, а проба достигнет 999.

Существует способ растворения золота раствором Люголя — соединением калия с йодом.
Применяется также квартование (от лат. quarta — четвёртая) — сплавление золота в пропорции 1:3 с другим металлом (латунью, цинком, медью), который впоследствии растворяется в азотной кислоте. Примеси не растворятся качественно, если их содержание менее ¾ объёма, поэтому полуфабрикат квартуется. Теоретически вы можете попробовать сделать это дома, но учитывайте, что при растворении выделяется очень ядовитый оксид азота.
Если у вас есть золото в виде раствора, его легко аффинировать порошком хлорида олова. Через сутки после начала процесса золото осядет на дно посуды, в которой вы оставили его. Способ с хлорным оловом хорош тем, что при его использовании организм оператора не подвергается опасности, как при работе с летучими хлоридами или кислотой.
Электролитический
Электролиз предполагает выделение составных компонентов сплава на электродах в результате прохождения электрического тока через электролит. При аффинаже анодом (электродом с положительным потенциалом) выступает золотосодержащий сплав, а катодом (электродом с отрицательным потенциалом) — тонкая прокатная золотая (999) жесть. Электролит — раствор хлорного золота и кислоты, которая растворяет анод.

Исходная проба анода — минимум 900. Процесс происходит в небольших фарфоровых ваннах (
25 л), установленных на водяные бани для сохранения температуры 50–60 °С. Частицы золота оседают слоями на катоде. После окончания процесса анодный шлам отправляют на дальнейшую обработку: отделяют серебро и переплавляют в аноды для серебряного электролиза.
Какие способы аффинирования можно провести в домашних условиях
Конечно, провести опыт с хлором дома вы не сможете. Но можно попробовать добыть золото из лома или компьютерных отходов с помощью хлорного олова и кислот. Умелые алхимики могут воспользоваться электролитическим методом. Но не забывайте о технике безопасности!
Как извлечь золотой металл из карт памяти, микросхем и радиодеталей
Технический мусор вроде транзисторов и микросхем действительно содержит золото, тонким слоем покрывающее контакты и разъёмы. Корпуса деталей покрыты коваром — сплавом железа с никелем и кобальтом, — поэтому извлечение золота заключается в растворении ковара азотной кислотой (в которой золото, как мы уже знаем, не растворяется).

Из полученного материала остатки ковара выбираются мощным магнитом (лучше использовать неодимовый).
Процесс аффинажа золота в домашних условиях
Если решено провести опыт дома, нужно подготовиться. В первую очередь — подумать о технике безопасности: понадобятся маска для защиты от испарений, перчатки и осторожность. Экспериментировать можно только в отлично проветриваемом помещении, куда не имеют доступа дети и животные.
Необходимое сырье, приспособления и реактивы
Представим, что мы смогли достать всё необходимое для работы и решили попытаться. Займёмся квартованием: доведём пробу золота до 200–250, разбавив исходный материал медью, а потом растворим лигатуру. Цинк растворился бы быстрее меди, но сплав с ним очень хрупкий, а медь проще контролировать новичку.
Для аффинажа нам понадобятся:
- золотой лом, пробу которого будем повышать;
- два тигля (можно купить или самостоятельно вылепить из шамотной глины и обжечь);
- медь 999 пробы (удобно купить гранулированную из расчёта N×3–m, где N — примерная масса золота в нашем ломе, а m — примерная масса лигатуры);
- азотная кислота (тоже продаётся, её количество должно в 10 раз превышать общее количество металла);
- соляная кислота;
- бура (антисептик тетраборат натрия, есть в аптеке);
- горелка для плавления;
- деревянная (берёзовая, осиновая) палочка для размешивания расплава (некоторые ювелиры рекомендуют брать графитовые карандашные стержни);
- длинный пинцет;
- марля;
- колпак с отверстием для накрывания тигля;
- электроплитка;
- стеклянная огнеупорная колба для кипячения.
Подготовка
Допустим, у нас есть 20 г ювелирного золота 585-ой пробы, то есть сплавленные 11,7 г чистого металла и 8,3 г примесей. Для квартования потребуется медь в количестве 26,8 г (11,7×3–8,3).
- Измельчаем лом — например, с помощью кусачек.
- Просушиваем и прокаливаем тигли, иначе есть риск, что они лопнут.
- В исходное золото пинцетом добавляем медные гранулы и размешиваем до равномерного расплава, не прекращая нагревать. Каждый новый кусочек берём после того, как расплавлен предыдущий.
- Массу раскатываем или гранулируем, вылив в воду тонкой струйкой (сплав с цинком можно измельчить даже в ступке).
Процесс аффинирования
Важно: эта часть процесса проводится только на свежем воздухе, в противном случае она опасна для жизни! Идеальный вариант — дачный участок, на который дотягивается удлинитель для подключения электроплитки.
Добавляем в колбу с измельчённым металлом 60–70 мл азотной кислоты По мере утихания реакции добавляем ещё 40–50 мл, чтобы взаимодействие возобновилось (общий объём кислоты не должен превышать 200 мл). Процедуру повторяем 2–3 раза, после чего доводим колбу до кипения.
Осадок промываем чистой водой, добавляя её в колбу, пока смесь не станет прозрачной, и аккуратно сливая. После с небольшим количеством воды, обильно посыпав бурой, помещаем золото в чистый тигель (удобно для этого воспользоваться марлей — получится «узелок» из золотых хлопьев).
Тигель с завёрнутым золотом, посыпанным бурой, прикрыв колпаком, держим на огне, пока марля не истлеет. Убедившись, что смесь буры и золота стала более или менее однородной, переходим к плавлению. Расплавленный металл снова посыпаем бурой.
Процесс аффинажа можно считать завершённым, когда начинающее застывать золото не мутнеет, а остаётся блестящим. Пока этого не происходит, продолжаем плавить его и посыпать бурой.
Чистое золото плавится очень красиво. Как плавят его профессиональные ювелиры, можно увидеть на видео:
Способы очистки аффинированного золота
Когда слиток затвердеет, нужно будет очистить его от буры составом:
- 20 мл соляной кислоты;
- 10 мл азотной кислоты;
- 500 мл дистиллированной воды.
Слиток помещается в колбу, заливается смесью воды и кислот и кипятится в течение пяти минут.
После этого нам останется только промыть золото водой.
Заключение
Конечно, не каждый из нас рискнет экспериментировать с аффинажем дома, но знать, как сделано кольцо ручной работы, которое мы хотим подарить подруге, тоже интересно. Поэтому следите за новостями и не забывайте, что я рад каждому подписчику!
Читайте также:

