Какие соли могут быть использованы в ювелирном деле
Опубликовано: 24.07.2024
8. Кислоты, щелочи, соли в ювелирном производстве
В ювелирном производстве употребляются различные кислоты, щелочи и соли, которые используются для растворения металлов и необходимы при многих процессах обработки изделий.
Кислоты. В ювелирном производстве применяются серная, азотная, соляная и плавиковая кислоты, а также смесь азотной и соляной кислот ("царская водка").
Серная кислота - маслянистая бесцветная тяжелая жидкость. Температура кипения ее 338°С, плотность 1,84 г/см3. Смешивается с водой в любых соотношениях, выделяя при этом значительное количество тепла. Для приготовления водного раствора серной кислоты необходимо кислоту вливать в воду, а не наоборот, так как при вливании воды в кислоту происходит выбрасывание жидкости из сосуда, которое может стать причиной несчастного случая.
Концентрированная серная кислота обугливает дерево, бумагу, ткани, кожу, растворяет многие металлы, образуя химические соединения, называемые сернокислыми солями. Применяется при травлении, а также для составления раствора для очистки от буры и придания соответствующего цвета основному металлу.
Азотная кислота - бесцветная жидкость. Температура кипения ее 86°С, плотность 1,52 г/см3. Разрушает растительные и животные ткани, растворяет многие металлы, образуя азотнокислые соли. Применяется при травлении благородных и цветных металлов, а также для составления отбеливающего раствора.
Концентрированная азотная кислота применяется очень редко, обычно употребляются водные растворы азотной кислоты различной крепости. Азотная кислота является составной частью "царской водки". Условия хранения аналогичны условиям хранения серной кислоты, т. е. в стеклянной посуде с притертой пробкой.
Соляная кислота - бесцветная жидкость с резким характерным запахом. Плотность 1,19 г/см3. Применяется при травлении черных и цветных металлов. Соляная кислота не растворяет платину, золото и серебро. Применяется для осаждения серебра из его растворов, а также для приготовления "царской водки" и отбеливающего раствора.
Плавиковая кислота - водный раствор 35-40%-ного фтористого водорода. Для приготовления плавиковой кислоты первоначально готовят известковую кислоту действием серной кислоты на плавиковый шпат. В результате реакции образуется газ, который, растворяясь в воде, образует плавиковую кислоту - бесцветную жидкость с резким запахом. Температура кипения ее 19,5°С. Металлы взаимодействуют с плавиковой кислотой медленнее, чем с соляной и серной кислотами. Плавиковая кислота растворяет двуокись кремния, поэтому ее нельзя хранить в стекле, керамике. Хранят ее в сосудах из парафина, эбонита, хлорвинила, полиэтилена, полистирола, каучука, свинца. Золото и платина с плавиковой кислотой не реагируют. Применяют плавиковую кислоту для травления стекла, очистки литьевых заготовок от формовочной массы.
"Царская водка" - это смесь одной части азотной кислоты и двух-трех частей соляной кислоты. Жидкость красно-коричневого цвета, которая растворяет металлы, нерастворимые в каждой из этих кислот в отдельности (золото, серебро). Это объясняется тем, что при смешивании этих кислот между ними происходит реакция, в результате которой выделяется свободный хлор, превращающий металл в растворимое хлористое соединение. Применяется для опробования сплавов золота.
Щелочи. К распространенным щелочам, применяемым в ювелирном производстве, относятся едкий натр, едкий калий и нашатырный спирт.
Едкий натр - гидрат окиси натрия, каустическая сода. Хорошо растворяется в воде со значительным выделением тепла, гигроскопичен, сильная щелочь (разъедает кожу, ткани). Хранится в герметически закрытых железных барабанах. Температура плавления его 318°С, температура кипения 1388°С.
Едкий калий - твердая непрозрачная масса с лучистым изломом, сильная щелочь, по свойствам сходная с едким натром. Температура плавления его 360°С, температура кипения 1324°С. Применяется при обезжиривании и оксидировании. Хранится в герметически закрытых железных барабанах.
Нашатырный спирт - гидрат окиси аммония, раствор аммиака в воде. Применяется для нейтрализации кислоты на изделиях после травления и для других целей.
Соли - вещества, представляющие собой кислоты, в которых водород замещен металлом.
Сода - это общее название различных по химическому составу соединений натрия. Применяется несколько видов соды: кальцинированная, каустическая (едкий натр), двууглекислая. Наибольшим распространением пользуется сода кальцинированная в виде белого мелкого порошка. Температура плавления 852°С, плотность 2,53 г/см3. Растворяется в воде с выделением тепла.
Поташ - порошок белого цвета - гигроскопичен, хорошо растворяется в воде. Температура плавления 891°С, плотность 2,29 г/см3.
Бура - водная натриевая соль борной кислоты, бесцветные кристаллы или порошок. При нагревании плавится и обладает свойством растворять окиси металлов, песок и глину, образуя легкоплавкие хрупкие соединения, называемые шлаками. На этом свойстве основано применение буры при плавке и пайке металлов.
Медный купорос - сернокислая медь, кристаллы сине-голубого цвета. Плотность 2,3 г/см3. Применяется при меднении, латунировании и оксидировании.
Сернокислая закись - окись меди. Применяется при меднении и латунировании.
Хлористое серебро представляет собой белый порошок, плавится при 455°С, образуя желтую жидкость. Получается при добавлении к раствору азотнокислого серебра соляной кислоты или поваренной соли до прекращения выделения белого осадка. Осадок фильтруют, промывают и сушат в темном месте при температуре 80-90°С. Хлористое серебро почти нерастворимо в воде и добавленных кислотах. Хорошо растворимо в цианистом калии и в водном растворе аммиака. В некоторых случаях применяется при составлении электродов для серебрения.
Цианистое серебро получается из раствора азотнокислого серебра в результате реакции с цианистым калием. Применяется в гальванотехнике при составлении электродов для серебрения. Плотность 3,96 г/см3.
Хлорное золото получается под действием хлора или "царской водки" на металлическое золото. Обычно для приготовления хлорного золота металлическое золото растворяют в "царской водке". Полученный темно-коричневый раствор упаривают, образовавшийся осадок растворяют в воде. Хлорное золото применяется при составлении электролитов для золочения.
Цианистый калий применяется в процессе приготовления электролитов для золочения и серебрения, а также для других целей. Температура плавления 634,5°С, плотность 1,52 г/см3. Цианистый калий - сильнодействующий яд.
Цианистый натрий - соль, близкая по свойствам к цианистому калию. Температура плавления его 563,7°С.
Азотнокислое серебро (ляпис) получается растворением металлического серебра в азотной кислоте с последующим выпариванием раствора; представляет собой большие белые кристаллы ромбической формы, плавящиеся при температуре 208,5°С. Плотность 4,3 г/см3. Азотнокислое серебро несветостойко и ядовито, легко растворяется в воде, применяется при серебрении.

Бура (Na2B4O7) — натриевая соль тетраборной кислоты. Образует большие бесцветные прозрачные кристаллы. В порошке похожа на борную кислоту, но более шелковиста на ощупь. Чтобы отличить буру от борной кислоты, достаточно немного того и другого вещества насыпать в сосуд с водой — борная частично остается на поверхности воды в виде пыльцы, а бура тонет. Плотность буры 1,7—1,8 г/см 3 . При нагревании до 450°С бура теряет кристаллизационную воду, затем при температуре 741°С плавится, образуя прозрачную стекловидную массу. Расплавленная бура обладает свойством растворять окислы металлов. Это свойство используют при плавке и пайке металлов.
Бура применяется как самостоятельный флюс или как основа флюсов при всех ювелирных пайках. Используется она и для приготовления черни.
Хлористый натрий, или поваренная соль (NаСl) — служит сырьем для производства хлора, соляной кислоты, едкого натра, соды. Плотность 2,16 г/см3; температура плавления 800°С. Хорошо растворим в воде.
Хлористый натрий является компонентом растворов для химического травления и пассивирования (процесс образования прозрачной защитной пленки) ювелирных изделий.
Силикат натрия (NaSiO3) — жидкое стекло, получаемое при сплавке двуокиси кремния (SiO2) с едким натром (NaОН). • Сплав растворим в воде, за что получил название растворимого стекла. Плавится при температуре 1088°С.
Жидкое стекло входит в состав электролитов для золочения, родирования, серебрения и является связующим веществом при изготовлении шамотных и магнезитовых тиглей для плавки платины.
Карбонат натрия (углекислый натрий), или сода (Na2СОз) — соль угольной кислоты.
Хорошо растворим в воде. Полученная аммиачным способом сода не содержит кристаллизационной воды и называется кальцинированной содой. Плотность 2,5 г/см 3 ; температура плавления 851°С.
При гальванических процессах в ювелирной промышленности кальцинированная сода применяется для приготовления обезжиривающих растворов, а также входит в состав моющих средств.
Едкий натр, или каустическая сода (NаОН),— гидроокись натрия, представляет собой твердое белое вещество. Очень гигроскопичен. Плотность 2,1 г/см 3 ; температура плавления 318°С. Разъедающе действует на ткани, кожу, бумагу и другие органические вещества. Хорошо растворяется в воде.
Едкий натр используется для приготовления электролитов при золочении и обезжиривании ювелирных изделий при родировании и серебрении.
Селитры — натриевая (NаNO3) и калиевая (КаNО3) — соли азотной кислоты. Образуют бесцветные кристаллы. Плотность КаNО3 — 2,25 г/см 3 ; температура плавления 308°С. Плотность КаNО3 — 2,1 г/см 3 ; температура плавления 334°С. Обе селитры хорошо растворяются в воде. При нагревании до температуры плавления золота, серебра и их сплавов селитры разлагаются и образующийся кислород взаимодействует с элементами шихты, переводя их в окислы.
Селитры применяются как составная часть флюса для очистительных сплавов.
Цианистый калий (КСN) — соль синильной кислоты (НСN). Образует бесцветные кристаллы. Как и сама синильная кислота, цианистый калий очень ядовит. Легко растворяется в воде. Плотность 1,25 г/см 3 ; температура плавления 34,5°С.
Широко используется в ювелирной промышленности при гальванических процессах: дли приготовления электролитов золочения, серебрения и химического обезжиривания.
Железистосинеродистый калий (К4[Fе(СN)6]*ЗН2O)—ферроционид калия. Кристаллизуется в виде больших светло-желтых призм, растворимых в воде. Плотность 1,84 г/см 3 . При нагревании разлагается.
Применяется для составления электролитов при серебрении.
Хромовокислый калий (K2CrO4) — хромат калия, представляет собой соль хромовой кислоты в виде кристаллов желтого цвета. Плотность 2,7 г/см 3 ; температура плавления 975°С. Растворим в воде.
Применяется для приготовления растворов электрохимического оксидирования серебра. При подкислении раствора хромата происходит реакция превращения в бихромат — двухромовокислый калий.
Двухромовокислый калий, или хромпик (К2Cr2O7), — соль двухромовой кислоты (H2Cr2O7). Образует кристаллы ярко-оранжевого цвета. Плотность 2,7г/см 3 ; температура плавления 398°С. Растворяется в воде, лучше в теплой.
Применяется для приготовления пробирных реактивов, а также входит в состав электролитов химического травления и пассивирования ювелирных изделии из серебра и медных сплавов.
Йодистый калий (KI) — соль йодистого водорода (HI). Образуется в виде мелких кристалликов темно-бурого цвета. Плотность 3,13 г/см 3 ; температура плавления 723°С. Растворим в воде и кислотах.
Применяется при приготовлении пробирных реактивов для пробирования серебряных и платиновых сплавов.
Поташ, или карбонат калия (К2СO3),— соль угольной кислоты. Белое порошкообразное вещество, легко растворимое в воде и расплавляющееся во влажном воздухе. Плотность 2,29г/см 3 ; температура плавления 891°С.
Применяется как один из компонентов «серной печени» — для оксидирования серебра, как флюс и составная часть флюса при плавке драгоценных металлов; входит в состав электролита для блестящего золочения.
Хлористое серебро (АgCl) — белый творожистый осадок, не растворимый в воде. Растворяется в цианистом калии (КСN) и гидроокиси аммония (NH4OH). Плотность 5,56 г/см 3 ; температура плавления 445°С.
Широко используется для составления электролитов при серебрении.
Азотнокислое серебро. или ляпис (AgNO3), — нитрат серебра. Является солью азотной кислоты. Образует бесцветные прозрачные кристаллы. Плотность 4,35 г/см 3 ; температура плавления 212°С. Разлагается при температуре 444°С. Кристаллы легко растворимы в воде и глицерине, почти не растворимы в спирте.
Применяется при составлении электролитов для серебрения и приготовлении пробирных реактивов для пробирования серебра.
Хлорное золото (АuCl) — соль золотохлористоводородной кислоты. Образует кристаллы красновато-коричневого цвета. Плотность 3,9г/см 3 ; температура разложения 254°С. Легко растворимо в воде, спирте, эфире.
Применяется для приготовления пробирного реактива «хлорное золото» и электролитов для золочения.
Источник: В.И. Марченков «Ювелирное дело», Москва, 1975г.
Бура (Na2B407 • 10Н2О) - натриевая соль тетраборной кислоты. Образует большие бесцветные прозрачные кристаллы. В порошке похожа на борную кислоту, но более шелковиста на ощупь. Чтобы отличить буру от борной кислоты, достаточна немного того и другого вещества насыпать в сосуд с водой - борная частично остается на поверхности воды в виде пыльцы, а бура тонет. Плотность буры 1,7. 1,8. При нагревании до 450 °С бура теряет кристаллизационную воду, затем при температуре 741 °С плавится, образуя прозрачную стекловидную массу. Расплавленная бура обладает свойством растворять оксиды металлов. Это свойство используют при плавке и пайке металлов. Бура применяется в качестве флюса при плавке и пайке драгоценных металлов, а также в качестве составляющего компонента флюсов. Является составной частью эмалей, используется при приготовлении черни.
Хлористый натрий, или поваренная соль (NaCl), - служит сырьем для производства хлора, соляной кислоты, едкого натра, соды. Плотность 2,16; температура плавления 800 °С. Хорошо растворим в воде. Хлористый натрий является компонентом растворов для химического травления и пассивирования (процесс образования прозрачной защитной пленки) ювелирных изделий.
Силикат натрия (NaSi03) - жидкое стекло, получаемое при сплавлении диоксида кремния (Si02) с едким натром (NaOH). Сплав растворим в воде, за что получил название растворимого стекла. Плавится при температуре 1088 °С. Жидкое стекло входит в состав электролитов для золочения, родирования, серебрения и является связующим веществом при изготовлении шамотных и магнезитовых тиглей для плавки платины.
Карбонат натрия (углекислый натрий), или сода (Na2C03), - соль угольной кислоты. Хорошо растворим в воде. Полученная аммиачным способом сода не содержит кристаллизационной воды и называется кальцинированной содой. Плотность 2,5; температура плавления 851 °С.
При гальванических процессах в ювелирной промышленности кальцинированная сода применяется для приготовления обезжиривающих растворов, а также входит в состав моющих средств.
Едкий натр, или каустическая сода (NaON), - гидроксид натрия, представляет собой твердое белое вещество, очень гигроскопичен. Плотность 2,1; температура плавления 318°С. Разъедающе действует на ткани, кожу, бумагу и другие органические вещества. Хорошо растворяется в воде.
Едкий натр используется для приготовления электролитов при золочении и обезжиривании ювелирных изделий при родировании и серебрении.
Селитры - натриевая (NaN03) и калиевая (KN03) - соли азотной кислоты. Образуют бесцветные кристаллы. Плотность Км^°3
2'25; температура плавления 308 °С. Плотность iN03 - 2,1; температура плавления 334 °С. Обе селитры хорошо растворяются в воде. При нагревании до температуры Плавления золота, серебра и их сплавов селитры разлагаются и образующийся кислород взаимодействует с элементами шихты переводя их в оксиды.
Селитры применяются как составная часть флюса для очистительных сплавов.
Цианистый калий (KCN) - соль синильной кислоты (HCN), Образует бесцветные кристаллы. Как и сама синильная кислота, цианистый калий очень ядовит. Легко растворяется в воде, Плотность 1,25; температура плавления 634,5 °С. Широко используется в ювелирной промышленности при гальванических процессах: для приготовления электролитов золочения, серебрения и химического обезжиривания.
Железистосинеродистый калий К4 [Fe(CN)6 • ЗН20] - ферроцианид калия. Кристаллизуется в виде больших светло-желтых призм, растворимых в воде. Плотность 1,84. При нагревании разлагается. Применяется для составления электролитов при серебрении,
Двухромовокислый калий, или хромпик (К2СГ2О7), - соль двухромовой кислоты (Н2Сг207). Образует кристаллы ярко-оранжевого цвета. Плотность 2,7; температура плавления 398 °С. Растворяется в воде, лучше в теплой. Применяется для приготовления пробирных реактивов, а также входит в состав электролитов химического травления и пассивирования ювелирных изделий из серебра и медных сплавов.
Йодистый калий (KJ) - соль йодистого водорода (HJ). Образуется в виде мелких кристалликов темно-бурого цвета, Плотность 3,13; температура плавления 723 °С. Растворим в воде и кислотах. Применяется при приготовлении пробирных реактивов для опробования платиновых сплавов.
Поташ, или карбонат калия (К2СО3), - соль угольной кисло ты. Белое порошкообразное вещество, легкорастворимое в воде и расплавляющееся во влажном воздухе. Плотность 2,29; температура плавления 891 °С. Применяется как один из компонентов «серной печени» - для оксидирования серебра, как флюс и составная часть флюса при плавке драгоценных металлов; входит в состав электролита для блестящего золочения.
Хлористое серебро (AgCl) - белый творожистый осадок, не растворимый в воде. Растворяется в цианистом калии (KCN) и гидроксиде аммония (NH4OH). Плотность 5,56; температура плавления 445 °С. Широко используется для составления электролитов при серебрении.
Азотнокислое серебро, или ляпис (AgN03), - нитрат серебра Является солью азотной кислоты. Образует бесцветные прозрачные кристаллы. Плотность 4,35; температура плавления 212 °С Разлагается при температуре 444 °С. Кристаллы легкорастворимы в воде и глицерине, почти не растворимы в спирте.
Применяется при составлении электролитов для серебрения и приготовлении пробирных реактивов для опробования серебра.
Хлорное золото (AuCl) - соль золотохлористоводородной кислоты. Образует кристаллы красновато-коричневого цвета. Плотность 3,9; температура разложения 254 °С. Легкорастворимо в воде, спирте, эфире. Применяется для приготовления пробирного реактива «хлорное золото» и электролитов для золочения.


Ювелирные изделия (украшения из драгоценных металлов и камней), их производство, хранение и уход за ними, требуют особых знаний и умений, а также наличия оборудования и инвентаря, задействования специальных химических веществ для выполнения тех или иных задач. Именно о химии, которая может понадобиться, мы и поговорим детальнее в данной статье.
Химические соединения для ювелирных изделий: что и для чего нужно?
Основной пласт реактивов используют для растворения металлов и обработки изделий. Ювелиру в работе часто необходимы следующие группы веществ:
Кислоты
Без них не обойтись в художественной металлообработке, где они выступают вспомогательными компонентами для основных производственных этапов. Кислоты состоят из атомов водорода и кислотных остатков. Взаимодействуя с металлами, оказывают на них значительное влияние. При работе с кислотами важно соблюдать меры предосторожности. Разбавлять материал до рабочей концентрации нужно так: в специально отведенную емкость вливаете воду, после тонкой струей добавляете кислоту и помешиваете. В конце не забудьте охладить.
В ювелирном деле наибольшее распространение получили такие из них:
√ Соляная кислота. Жидкое вещество маслянистой консистенции, не имеющее цвета, но обладающее резким специфическим запахом. Растворение в воде – высокое, взаимодействие с различными металлами – легкое (с формированием солей и выделением водорода). С ее помощью производят травление металлов, создают отбелы (отбеливающие растворы) и пробирные реактивы.
Едва ли не главная ее задача – служить компонентом «царской водки» совместно с азотной кислотой. «Царская водка» – это сильный окислитель, с помощью которого можно растворять почти все металлы. Большинство из них, в том числе и золото – при комнатной температуре, некоторые, например, платину – при нагреве.
√ Серная кислота. Аналогично к предыдущему, бесцветный маслянистый жидкий реактив. Сочетаясь с H2O, высвобождает значительный объем тепла. В концентрированном виде при нагреве растворяюще действует на многие металлы (за исключением Pt и Au), образует сернокислые соли. Находит применение при травлении металлопримесей, получении Au из руд. Вместе с бурой является составляющей отбелов. Придает основному металлу соответствующий окрас.
√ Азотная кислота. Не имеющая цвета жидкость, смешивающаяся с водой в различных пропорциях. На воздухе немного дымится. Под световым воздействием поддается разложению на воду, кислород и NO2. Это одна из наиболее мощных кислот, под ее действие подпадает практически любой металл (кроме Pt и Au). При этом наблюдается трансформация в соли (нитраты). Используется в большинстве случаев в форме водных растворов той или иной концентрации.
С ее участием создают пробирные реактивы и отбеливающие растворы, травят примеси благородных металлов (кроме Ag). Как уже было упомянуто, это один из важнейших компонентов «царской водки», имеющей способность к растворению металлов (Au и Ag), не поддающихся воздействию азотной и соляной кислот, применяемых по отдельности.
√ Борная кислота. Твердое соединение белого окраса, сформированное кристаллами. Слабая кислота с легким растворением в нагретой воде. При нагреве избавляется от воды, трансформируясь в конечном итоге в оксид бора. Она – составляющая флюсов, которые задействуются при спаивании благородных металлов.
Щелочи
Это гидроксиды щелочных/щелочноземельных металлов. К ним принадлежат хорошо растворяющиеся в водной среде основания. Из данной группы могут быть задействованы основные ее представители:
- каустическая сода (едкий натр), применяющаяся в изготовлении электролитов для нанесения золотого слоя и удаления жиров из поверхности украшений при покрытии родием и серебром;
- гидроксид калия (едкое кали), предназначенный для изъятия жиров и формирования оксидной пленки;
- нашатырный спирт, основная задача которого – нейтрализация кислот на ювелирной продукции после травления.
Соли
Соединения, похожие на кислоты, но в отличие от них, в своей структуре вместо водорода имеют металл.
√ Бура 10-водная. Тетраборат натрия, соль в форме порошкообразной массы белого окраса. Хорошему растворению поддается в горячей воде и глицерине. Сама же растворяет металлические окислы. При плавлении металлов, а также паянии и задействуется. Может служить отдельным флюсом или флюсовой базой в любой ювелирной пайке. Кроме того, с ее помощью готовят чернь.
√ Сода кальцинированная. Карбонат натрия, соль H2CO3 с высокой растворимостью в водной среде. Применяется в гальванопроцессах для создания обезжиривателей и очистительных композиций.
√ Сульфид натрия. Натрий сернистый, бескислородная соль в форме белого сильно гигроскопичного порошка. Проявляет термоустойчивость, при плавке не разлагается. В H2O поддается хорошему растворению, с созданием сильнощелочной среды. Задействуется в плавке металлов.
√ Гипофосфит натрия. Фосфорноватистокислый натрий, соединение неорганической природы в виде не имеющих цвета кристаллических образований. Растворение в воде – отличное, с формированием у раствора нейтральной реакции. Компонент растворов хим. никелирования. √ Калий сернокислый кислый. Гидросульфат калия, твердое вещество, сформированное белыми кристаллами. В водных средах растворяется прекрасно. Используется для отбела (очистки ювелирных украшений) при t 100 °С. Выступает безупречным вариантом для очищения участков пайки и изъятия налета.
√ Гидроксиламин сернокислый. Гидроксиламин сульфат, важнейшая соль гидроксиламина в форме белых кристаллов, хорошо растворяющихся в H2O. Сильный восстановитель.
√ Тринатрийфосфат. Фосфат натрия, хим. материал в форме чешуек/кристаллов белого цвета, поддающихся слеживанию. Растворение в водной среде – оптимальное. Выступает частью растворов для хим. и электрохим. обезжиривания металлов (в частности, Au и Pt), электролитов для покрытия методом блестящего золочения, задействуется и при нанесении серебряной пленки.
Среди других солей, которые не редко применяются ювелирами:
- хлорид натрия (составляющая часть растворов для хим. травления и пассивации);
- силикат натрия (компонент электролитов для нанесения Au, Rh и Ag, а также связка тиглей для плавления платины);
- нитрат калия и натрия (исходники флюсов для сплавов-очистителей);
- цианид калия (принимает участие в гальванопроцессах, а именно в создпнии электролитов для покрытия Au и Ag, а также в хим. удалении жиров);
- хромовокислый калий (используется при создании растворов электрохим. оксидирования Ag);
- бихромат калия (компонент пробирных реактивов, электролитов хим. травления и пассивации продукции из Ag и Cu-сплавов);
- йодид калия (еще один представитель пробирных реактивов, предназначенных для определения качества сплавов из Ag и Pt);
- карбонат калия (составляющий элемент «серной печени», принимает участие в оксидировании Ag, выступает флюсом или его компонентом при плавке и входит в состав электролита для блестящего нанесения пленки золота);
- хлорид серебра (необходим для электролитов при создании пленок Ag);
- азотнокислое серебро (важно при работе с серебром, в частности входит в электролиты для серебрения и пробирные реагенты для данного металла);
- хлорное золото (элемент одноименного пробирного реактива и электролитов золочения).
Трихлорэтилен. Хлорорганическое соединение в виде бесцветной прозрачной жидкости с характерным запахом, близким к хлороформу, и сладко-жгучим вкусом. Используется в нанесении слоя родия на изделия из Ag для обезжиривания.
Пробирные реактивы
Выше мы не раз упоминали о пробирных реактивах. Что это такое и для чего нужно – далее.
Пробирными именуют реактивы (в большинстве случаев это кислотные вещества), предназначенные для опробования драгоценностей и сплавов благородных металлов (установления их содержания). Они обязательны на каждом предприятии, специализирующемся на ювелирном деле. Кроме них, необходимо использовать приборный камень, благодаря которому сохраняется целостность продукции, определять сплавы можно в любых изделиях, а опробование осуществляется просто и быстро.
Как действуют пробирные реактивы? Если сплав выше указанной пробы, после их применения на нем не остается никаких следов. Если предписанной – появляется едва заметный след. Если ниже – темное пятно, так называемый ожог, интенсивность которого указывает на разницу в пробе.
Для разных металлов задействуются свои соединения: для Au – растворы хлорида золота, для Ag – растворы ляписа и ферроцианида калия, для Pt – кислотный реактив, такой же, как и для Au 958 пробы, а также смесь KI + HCl + HNO3 (эта же совокупность веществ применяется и для опробования палладия).
Чтобы опробовать золотомедные сплавы 583 пробы, берут реактив, состоящий из дистиллированной воды, HNO3 и HCl. Вообще HNO3 является главным материалом для вычисления золота в сплаве.
Самые популярные реактивы на солевой основе:
- хлорное золото. Состоит из хлористого аурума и H2O (23 г/л). Для его создания берут измельченное золото наивысшей 999 пробы, растворяют его в кислотной совокупности (HCl + HNO3) с небольшим подогревом. Когда получается темная оранжеватая масса (золото растворяется полностью), производят выпаривание до появления кристаллического осадка. После осуществляют растворение в очищенной воде в необходимой пропорции. Такой материал подходит для установления проб продукции из Au 583 пробы, для предшествующего исследования изделий, в содержании которых есть сомнения, а также для приблизительного пробоопределения, если показатель меньше 583, по характеристикам пятна;
- ляпис. Нитрат серебра берется в разных количествах и компонируется со 100 мл очищенной путем дистилляции воды. С его помощью определяют 750 (0,45 г AgNО3), 800 (0,5 г), 875 (0,7 г), 916 (0,75 г) пробы Ag. Для усиления эффекта вносят немного HNO3. В целом, процесс приготовления выглядит так: берут 10 г развальцованного или измельченного 999 серебра, растворяют в 15 мл хим. чистой нитратной кислоты при небольшом нагреве в заслоненной емкости. В результате этого выкристаллизовывается нитрат серебра, которому необходимо дать остыть до обычной t, а после растворить его в очищенной воде, отфильтровать и выпарить при t 100 °С до появления густой массы, сформированной кристаллами. Последующее выпаривание стоит выполнять с перемешиванием до достижения осадком сыпучести. Чтобы использовать данный реактив, осадок необходимо применять в указанных выше соотношениях.
Как получить ценные металлы из деталей?
То, что исходником драгоценных металлов может быть вторсырье (радиодетали), слышал далеко не каждый. А ведь это правда. Извлечение возможно путем электролиза и с помощью хим. реактивов, наиболее популярный из которых – «царская водка». Драгоценные металлы можно изымать из разных элементов. Для этого подходят микросхемы, полупроводниковые триоды, разъемы, детали очков и часов с позолотой и т.д.
Один из самых простых методов – вытравливание. В его основе – хим. инертность Au (способность не взаимодействовать с иными хим. элементами).
Если сравнить Au с Cu и Ag, то оно проявляет крайнюю инертность к О и сере. Реакция с галогенами возможна только при нагреве. Из этого следует, что растворение золота и трансформация его в раствор требуют задействования мощного окислителя. Именно таким и является знаменитая «царская водка» – желто-оранжевое жидкое вещество с хлорным и диоксидоазотным запахом. Причем как цвет, так и запах появляются не сразу после приготовления, а несколько позже: изначально материал бесцветный и без запаха. Важно его создавать непосредственно перед использованием. Ведь в процессе хранения не только цвето-ароматические изменения происходят, но и окисление уменьшается. Для создания необходимо взять HNO3 и HCl в пропорции 1:3. Серебро в «царской водке» растворяется, золото – нет. Трудно окисляются Cr, Ti, Ta, Zr, Hf и Nb.
Итак, в процессе вытравливания радиодеталей растворению поддаются все металлы, кроме Au. Оно плавает в кислоте тонкой золотой пленкой. Остается только отфильтровать его и промыть. Для промывки отлично подходит метиловый спирт.
Чтобы травить и восстанавливать золото, применяется чистая и не разбавленная азотная кислота. Для ускорения процесса золотодобычи рабочую емкость можно подогреть до 60-70 °С. До травления необходимо тщательно отделить от позолоченных все иных элементы.
Фольгу/порошок, полученные в процессе травления, можно просушить, а после взвесить. Далее для получения слитка материал следует переплавить в тигле с задействованием буры.
Учтите, что протравливание – не всегда гарантия безупречного получения золота. Не исключены потери до 10 %. Да и полученный слиток, скорее всего, не будет максимально чистым (в нем все равно будет присутствовать какая-то часть примесей других металлов). Понадобятся дополнительные очистительные мероприятия.
Чистка драгоценных металлов
Как вы уже поняли, изначально драгоценные металлы не являются чистыми. Необходимы специальные технологии, чтобы достичь надлежащей чистоты. Одна из таковых – аффинаж.
Аффинаж – это ювелирное очищение металлов для создания благородных металлов с высокой степенью чистоты (удаление примесей). Это непростой процесс. Для него нужны квалифицированные сотрудники, технологичное оборудование и специальные материалы. Наряду со шлифовкой, он включает хим. обработку и воздействие концентрированными веществами. Только весь комплекс очистительных работ позволяет достигать определенной чистоты.
Методы аффинажа:
- электролитический. Больше всего подходит для золота и серебра, ввиду осаждения чистых металлов и одновременного отделения примесей и взвесей, присутствующих в виде шлама. Результат – отличный: к примеру, золото получается не ниже 999,9 пробы. А еще этот метод самый выгодный в финансовом плане;
- мокрый. Задействуется для платины, иридия и палладия, которым свойственна сложная схема растворения. Именно здесь предвидится использование «царской водки» с целью удаления всяческих примесей;
- сухой. Еще один метод для обработки золота и серебра. Заключается в расплавлении металла реагентом, обычно, хлором. Значительная чистота (для золота – 996,5 проба, для серебра – 999) достигается выпариванием неблагородных металлов, хлориды которых улетучиваются в процессе обработки.
Одно из популярных веществ для аффинажа – гидразин гидрат. Бесцветное жидкое очень гигроскопичное вещество со специфическим запахом. Используется для разных драгоценных металлов, в том числе для платины, золота и серебра.
Если речь идет об аффинаже палладия, хорошо использовать аммиак водный 25 %. Внешне это прозрачное жидкое вещество, не имеющее цвета. Запах – резкий, растворение в воде – хорошее.
Ну и, конечно, не забываем о соляной и азотной кислотах. Они при аффинаже также необходимы.
Химия для ювелиров – тема объемная и очень важная. Хорошо ориентируясь во всех нюансах, не сложно преуспеть. И наоборот, если не знать, что к чему, можно не только навредить используемым материалам, но и понести немалый финансовый ущерб. Желаем, чтобы последний сценарий обходил вас десятой дорогой, а результаты работы с драгоценными металлами только радовали!
Начиная техникой и заканчивая продуктами питания, жизнь современного человека полна вещей, созданных им самим. Это не обязательно что-то плохое, и всё же слова “натуральный”, “природный” или “экологичный” могут стать решающими в покупке.
Насколько это оправдано в ювелирном искусстве? Попробуем разобраться!
Игра в имитацию
Начнем с четкого разделения понятий “имитация” и “синтетический камень”. Синтетические камни - те, что по внешнему виду, химическому составу и физическим свойствам соответствуют природным аналогам. Главное их отличие - лабораторное происхождение. Процесс их создания повторяет рост минералов в природных условиях - отсюда и выражение “искусственно выращенные”
Имитация повторяет только внешний вид камня, но не его состав и свойства. Зачастую для этого используют пластик или стекло. Такие вставки особенно часто используются для создания бижутерных украшений, но их можно встретить и в серебре. Как отличить имитацию от настоящих камней, можно узнать в других наших статьях.

Камни из пробирки. История изобретения способов выращивания драгоценных камней
В эпоху Возрождения алхимиков интересовало воссоздание дорогих материалов из более дешевых. Так они начали уделять особое внимание практической металлургии, горному делу и медицине. Многим известен легендарный “Философский камень” - некий реактив, при помощи которого металлы превращались в золото, а также создавался эликсир жизни.
И хотя алхимия так и не стала серьезной наукой, она всё же дала толчок к развитию современной химии и физики.

Уже в конце 19 века научные достижения позволили создать синтетические минералы. Они не только не отличались от природных, но и превосходили их по некоторым параметрам.
Синтетические рубины появились в Париже ещё в 1885 году. Они покорили покупателем разнообразием и ценой. Но так было только поначалу. Популярность синтетических рубинов подстегнула производителей поднять стоимость - всего за год она возросла вдвое. Впрочем, это не остановило поклонников драгоценного камня и вскоре искусственно выращенные рубины исчезли с прилавков магазинов.
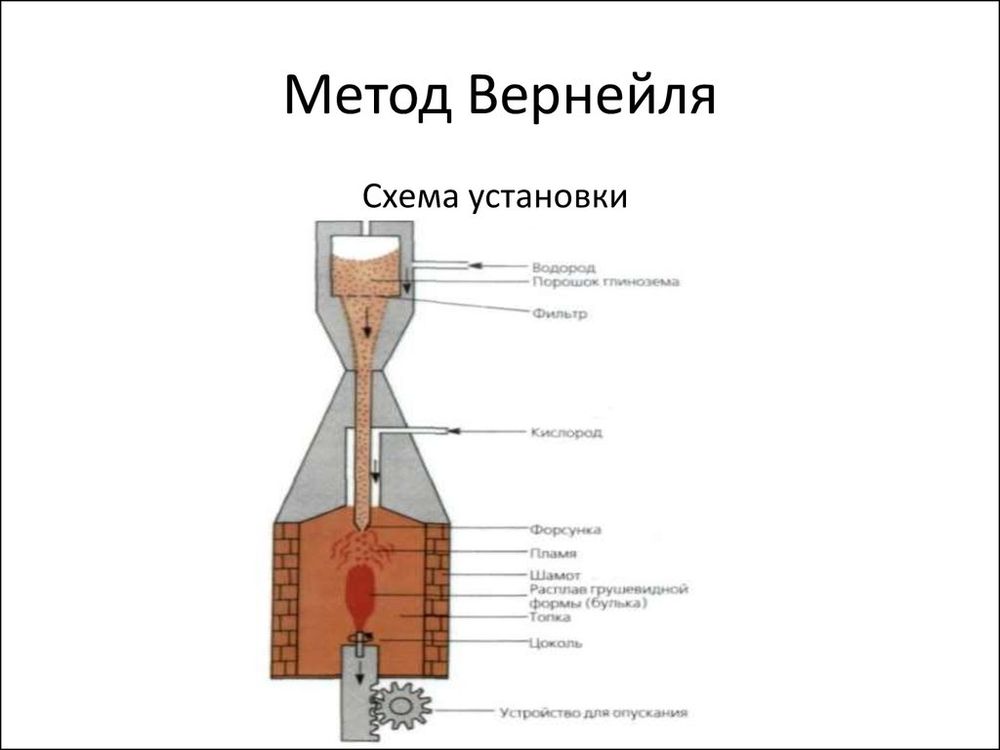
Переворот в этой области совершил французский химик Огюст Вернейль. В 1892 году он разработал способ выращивания монокристаллов для создания искусственных драгоценных камней. Его назвали “Метод Вернейля”.
Об успехах ученый рассказал всему миру в 1902 году, а спустя пять лет его лаборатория превратилась в промышленное производство, выпустившее тонну рубинов в 30 печах.
В промышленности с помощью “Метода Вернейля” синтезировали рубины, а позже и сапфиры, шпинели, александритоподобные рубины и другие камни.

Основные способы выращивания драгоценных камней: метод Вернейля, способ Чохральского, гидротермальный способ
Метод Вернейля стал первым промышленным способом выращивания драгоценных камней. Он заключается в следующем: к горелке с направленным вниз соплом через внешнюю трубу подводится водород, а через внутреннюю - кислород. К кислороду добавляется измельченный порошок окиси алюминия, нагревается и расплавляется под огнем гремучего газа. Под соплом располагается стержень запеченного корунда - кристаллоносца. На него стекается расплавленная окись алюминия, образуя шарик расплава.
Такой способ был распространен только в Европе. Его использовали “Sodem Djevahirdjian” в Швеции, “Baikowski” и “Rubis Synthdes” во Франции и “Weiders Carbidwerk” в ФРГ. С 1940-го года этот способ начал использоваться и в США, когда компания “Линде” наладила промышленный выпуск корундов.
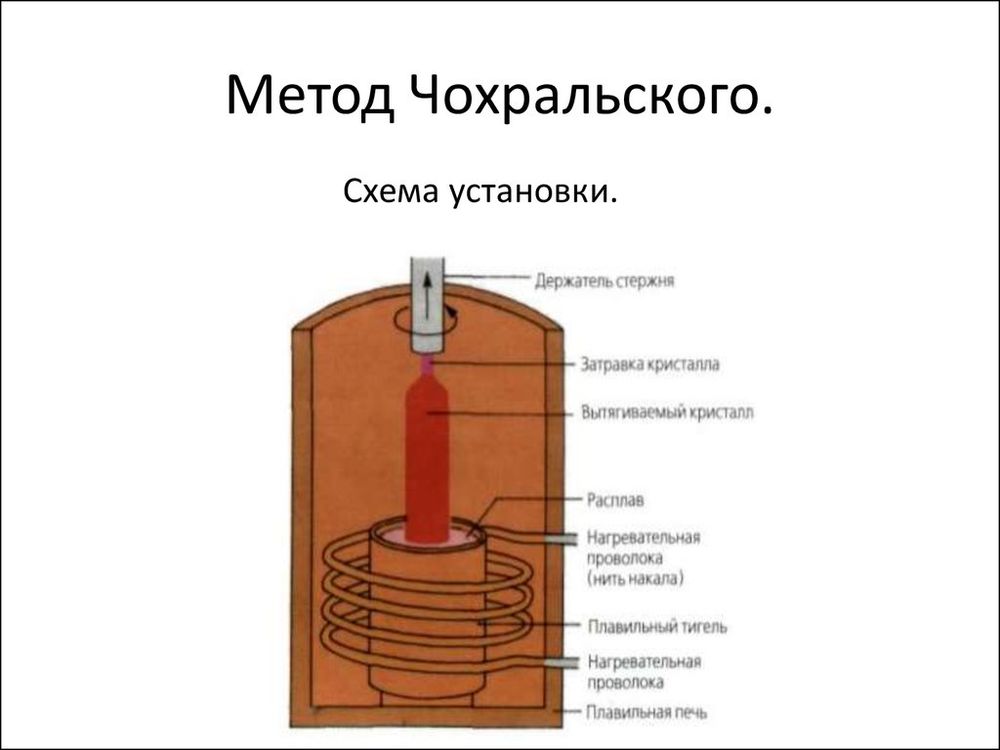
Второй распространенный метод - способ Чохральского. Расплав вещества для кристаллизации камней помещают в огнеупорный тигель и нагревают на высокочастотном индукторе. В расплав на вытяжном валу опускают материал будущего кристалла и наращивают до нужной толщины. Затем вал вращают для равномерного распределения примесей и выравнивания температуры.
Этот способ предполагает выпуск синтетических корундов любой формы, поэтому они нередко используется в технике.
Эффективен и гидротермальный способ выращивания камней. Процесс осуществляется в автоклавах, заполненных раствором нужного минерала. В нижней части механизма температура более высокая, поэтому, когда насыщенный раствор поднимается вверх и попадает в условия пониженной температуры, он осаждается.
Гидротермальный способ позволяет получить ювелирные камни весьма высокого качества. Именно им американская компания “Чатэм” изготавливает рубины размером до 60 мм.

И хотя метод Вернейля считается классическим, сейчас используются и совершенствуются все три способа.
Дело рук человека
Так как корунды состоят преимущественно из оксида алюминия, окрас регулируется малыми примесями других оксидов металлов. Так, для получения рубина используется окись хрома, сапфира - окись железа и титана, корунда с александритовым эффектом - соли ванадия.
Все эти камни - аналоги природным. Но отдельно хочется рассказать о том, что является полностью делом рук человека.
Например, о фианите. По своим показателям преломления этот камень близок к алмазу. На свету кристаллы фианита дают яркую дисперсию, в которой можно рассмотреть все цвета радуги. С помощью примесей можно получить различные цвета фианита: красный, розовый, оранжевый, голубой, белый, но не изумрудный.



Камень назван в честь Физического института Академии Наук СССР (ФИАН), где он был впервые синтезирован в 1970-1972-х годах. Но это имя знакомо только на территории бывшего СССР и Восточной Европы. В других странах его больше знают как “цирконий” - Cubic zirconia.
Интересный факт - у фианита всё же есть природный аналог - тажеранит. Но открыт он был позже, чем синтезирован фианит.
Почему синтетические камни лучше природных
Камни, созданные природой - произведение искусства, вызывающие восхищение. Но, как и произведения искусства, они не вечны. Месторождения натуральных камней стремительно исчерпываются. Для создания камня в лаборатории может понадобится около 2 часов, а в природных условиях куда дольше.
Вдохновившись природой, человеку удалось создать не просто нечто похожее, а полноценный прототип, который по ряду качеств превосходит свой природный аналог. Ювелирные камни выращивают в идеальных лабораторных условиях, а потому результат - материал высокого качества. Чистота, насыщенность цвета, оптические свойства - всё это регулируется и дает свободу для фантазии ювелиров.

Синтетические камни и более износостойки. Они не реагируют на жирную среду и более устойчивы к выцветанию.
Неоспоримым плюсом остается и стоимость изделия. Украшения с рубинами, изумрудами и сапфирами теперь могут себе позволить куда больше людей, чем в конце 19 века. Красота и доступность - вот что такое возможность создавать ювелирные камни.
Что же остается натуральным камням? Они всё так же используются в ювелирном искусстве, но гораздо реже. Это роскошь, многим недоступная для ювелирного гардероба. А ведь красота синтетического камня не уступает природному! Параллель с произведением искусства снова здесь применима - натуральные камни и роскошные украшения с ними скорее объект любования, а не использования.
Читайте также:

