Хлорное золото что это
Опубликовано: 22.04.2024
| Хлорид золота(III) | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | AuCl3 |
| Физические свойства | |
| Состояние (ст. усл.) | твердый, жидкий, газ; золотые, желтые кристаллы |
| Молярная масса | 303.325 г/моль |
| Плотность | 4,7 г/см³ |
| Термические свойства | |
| Температура плавления | 254 °C |
| Энтальпия образования (ст. усл.) | 28,3 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 68 г/100 мл |
| Растворимость в | растворим в эфире, мало растворим в жидком аммиаке |
| Структура | |
| Координационная геометрия | плоские площади |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 13453-07-1 |
| RTECS | MD5420000 |
Хлорид золота(III) (трихлорид золота) — бинарное неорганическое химическое соединение золота с хлором, химическая формула AuCl3.
Внешний вид — красные моноклинные кристаллы.
Получение
В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом железа(II) при температуре немного выше 200 °C. AuCl3 возгоняется при этой температуре в токе хлора и осаждается в форме красных игл удельного веса 3,9.
Давление разложения хлорида золота(III) при 251 °C достигает 1 атм. Теплота образования, по данным Бильтца, составляет 28,3 ккал/моль. При повышенном давлении хлора хлорид золота плавится при температуре 287—288 °C.
В воде он растворяется, давая коричнево-красную окраску, с образованием комплексной кислоты H2AuOCl3 (оксотрихлорозолото(III) кислота).
Золота(III) хлорид наиболее часто готовят путем пропускания газообразного хлора над золотым порошком при температуре 180 °C:

Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
хлорид золота(III) — хлористое золото(III) … Cловарь химических синонимов I
Хлорид золота — Хлорид золота неорганическое соединение золота с хлором. Известны следующие хлориды золота: Хлорид золота(I) AuCl; Хлорид золота(III) AuCl3; Хлорид золота(I,III) Au4Cl8; … Википедия
Хлорид золота(I) — У этого термина существуют и другие значения, см. Хлорид золота. Хлорид золота(I) … Википедия
Хлорид золота(I,III) — У этого термина существуют и другие значения, см. Хлорид золота. Хлорид золота(I,III) … Википедия
золота(III) хлорид — aukso(III) chloridas statusas T sritis chemija formulė AuCl₃ atitikmenys: angl. auric chloride; gold trichloride; gold(III) chloride rus. золота трихлорид; золота(III) хлорид; золото хлористое ryšiai: sinonimas – aukso trichloridas … Chemijos terminų aiškinamasis žodynas
Иодат золота(III) — Общие Систематическое наименование Иодат золота(III) Традиционные названия Иодноватокислое золото Химическая формула Au(IO3)3 Физические свойства … Википедия
Оксид золота(III) — Общие … Википедия
Бромид золота(III) — У этого термина существуют и другие значения, см. Бромид золота. Бромид золота(III) … Википедия
Нитрат золота(III) — Общие Систематическое наименование Нитрат золота(III) Традиционные названия Азотнокислое золото Химическая формула Au(NO3)3 Физические свойства … Википедия
Золотые сплавы отличаются друг от друга составом и процентным соотношением примесей. Определить пробу металла можно с использованием специальных химически составов. Реактивы для золота являются обязательными материалами для работников ломбардов, оценочных мастерских, ювелирных и антикварных салонов.
Стадии апробирования золота
Апробированию подлежит каждое изделие из драгоценного металла, которое идет на импорт или в реализацию через торговые сети. Процесс контролируется государственными органами пробирной палаты. На украшениях проставляют клеймо, которое указывает на процентное содержание золота в сплаве. Например, 750 проба говорит о том, что благородного металла содержится 75%, 585 проба указывает на 58,5% и т.д. Для удобства и систематизации клеймения разработаны государственные системы проб, самыми известными из которых являются метрическая и каратная. Последняя используется в западных странах.
Процесс апробирования изделий из золота состоит из нескольких стадий.

- Визуальный осмотр изделия. Особое внимание уделяют качеству клейма, его четкости, ровности линий и различимости. На подделках проба имеет неровную структуру, цифры и буквы плохо видны. Кроме этого, внимательное рассмотрение символов поможет выявить позолоту или бижутерию. Специалист при визуальном осмотре украшения легко определит его качество и принадлежность к той или иной группе сплавов.
- Зачистка изделия. С разрешения владельца часть поверхности украшения перед апробированием зачищают. Это необходимо для подтверждения того, что проверяемый экземпляр действительно золотой, а не позолоченный. Во время работы применяются надфили, напильники с мелкой насечкой и инструмент для точной обработки поверхностей металлических изделий — шабер. Процедуру выполняют с внутренней стороны изделия, как можно аккуратней и подальше от пробирного клейма.
- Нанесение реактива. После предварительного определения пробы на зачищенную часть украшения в вертикальном положении наносят реактив. Капля не должна растекаться. Важным моментом является время выдержки пробирного материала на поверхности. Оно изменяется в зависимости от типа реагента и пробы. Кислоты на металле с клеймами 375, 500 и 585 выдерживаются 5-10 с, а с клеймом 750 — 20 с. Хлорное золото должно находиться на поверхности 7-12 с, йодистый калий — не более 5 с. Несоблюдение временных отрезков приведет к искажению характерной химической реакции. По окончанию процедуры каплю реактива удаляют салфеткой или кусочком бязи.
Апробирование ювелирных украшений сопровождается характерными реакциями, в соответствии с которыми и устанавливается проба сплава. Процедура актуальна для изделий, клеймо на которых стерлось и плохо просматривается.
Виды реактивов и их действие на сплавы из золота
Проверка золотых украшений проводится с применением нескольких типов реактивов. Каждый из них используется для определенного сплава и оказывает на него характерное влияние.
Хлорное золото
Хлорное золото — реактив, применяемый для апробирования ювелирных изделий без указания проб. Таким образом, можно узнать, содержится ли в проверяемом сплаве драгметалл и в каком количестве.
Хлорное золото подходит для выявления подделок. С его помощью можно отличить настоящее золото от позолоты и бижутерии. Кроме этого реактив применим для белого драгметалла 500, 583/585 пробы.
Выбирая химический препарат для апробирования ювелирных изделий, нужно знать, что он работает только на сплавах с содержанием золота до 60%.
Кислотные реактивы
Кислотные составы для проверки драгоценных металлов представляют собой смесь азотной и соляной кислот в различных пропорциях. К ним добавляется дистиллированная вода. Например:
- азотная кислота плотностью 1,5;
- соляная кислота, плотностью 1,20;
- дистиллированная вода.
Количество реактивов напрямую зависит от проб исследуемых сплавов.
Действие кислотных реактивов на золото бывает двух видов. На одних изделиях они оставляют светлое пятно, на другие не оказывают никакой реакции. На высокопробные сплавы к химический элемент не действует, либо оставляет на них темные отметины.
Каждому кислотному реактиву соответствует определенная проба для анализа: 375, 750 и т.д. Чем меньше содержание золота в сплаве, тем более выраженный цвет будет иметь пятно от реагента.

Кислотные реактивы для определения золота
Кислотосодержащие препараты при апробировании золотых сплавов 375, 500, 750 пробы оставляют на зачищенном месте прозрачную каплю без какого-либо следа. В редких случаях появляется едва уловимая легкая тень.
Если реактив капнуть на изделие из недрагоценного металла, на его поверхности начнется определенная реакция с последующим пузырением и появлением зеленоватого осадка. Также появится специфический неприятный запах.
Раствор йодистого калия
Средство применяется для проверки сплавов с высоким содержанием драгметалла. С помощью этого химического вещества определяют подделки из металлов, которые устойчивы к другим реактивам. Реактив с раствором йодистого калия не действует на сплавах, проба которых начинается от 900. На изделии с клеймом 800 и на бижутерии с высокой химической устойчивостью образуется черное или зеленое пятно с возможным последующим пузырением.
Методика применения реактивов
Реактивы для золота могут достаточно точно определить их пробу, их удобно использовать в больших масштабах, а не в домашних условиях. Их применение для апробирования начинается с осмотра изделия. Иногда хватает одного взгляда на пробу, чтобы определить подделку. Клеймо может содержать асимметричные символы, кривые формы и изображения. Следующим шагом идет определение принадлежности сплава к группе низкопробного или высокопробного золота.
Поверхность изделия в определенном месте зачищается. Это помогает узнать, есть ли под золотым слоем другой металл или это единый сплав. Дальнейшая методика зависит от типа выбранного реактива.
Хлористое золото не одинаково действует на разные составы. Для проверки чистоты реагент наносят на поверхность украшения. Сплавы от 585 до 999 пробы никак не отреагируют на химическое соединение. На изделиях, в которых драгметалла содержится половина от общей массы, хлорное золото оставит темное пятно. Если же в материале ничтожно малое содержание желтого металла, менее 50%, реактив вызовет реакцию в виде сильного потемнения и появления осадка. Чем ниже проба, тем насыщенней будет цвет и сильнее осадок.
При использовании хлорного золота нужно быть очень внимательным и соблюдать время выдержки препарата на золотой поверхности. Капля должна быть небольшой и четко лежать на своем месте, не растекаясь по всему изделию. После завершения работ химикат сразу же убирают.

Перед применением реактивов поверхность изделия в определенном месте зачищается
Азотная кислота считается самым доступным и распространенным способом апробирования ювелирных украшений. На защищенную поверхность с помощью пипетки капают реактив и выжидают пару минут. Попадая на сплав ниже 583 пробы, кислота вызывает выделение газа. Чем ниже содержание золота, тем сильнее будет происходить пузырение под каплей. После проверки реагент сразу вытирают небольшим кусочком ткани или бумажной салфеткой.
Йодистый калий применяется аналогичным способом, как и предыдущие реактивы. Единственно, что нужно помнить, препарат действует только на сплавы с содержанием основного металла выше 80%.
Химические реакции различных проб золота на реактивы
Ниже в таблице приведены реакции сплавов различных проб на тот или иной реагент.
| Реактив/Проба | Хлорное золото | Кислоты | Йодистый калий |
|---|---|---|---|
| Ниже 375 | грязно-темно-зеленое, серо-зеленое пятно | грязно-темно-зеленое, серо-зеленое пятно | — |
| 375 проба | зеленовато-коричневое пятно | — | — |
| 500 проба желтого золота | светло-коричневое пятно | капля остается прозрачной. Каштановое пятно при использовании реактива для 585 пробы | — |
| 500 проба белого золота | пятна разных оттенков коричневого | пятна разных оттенков коричневого | — |
| 585 проба желтого золота | капля прозрачная | светлое пятно | — |
| 585 проба белого золота | пятно золотистого цвета | бежевое, золотистое или оранжевое пятно | — |
| 750 проба желтого золота | едва уловимое пятно | едва уловимое пятно | — |
| 750 проба белого золота | светло-коричневое пятно | светло-коричневое пятно | — |
| 800 и 900 пробы | — | — | темно-красное пятно |
Меры безопасности при работе с химическими реактивами
Химические реактивы довольно агрессивные вещества, поэтому при работе с ними необходимо придерживаться определенных правил безопасности. Особенно это касается использования кислот.
На поверхность, где будет проходить процедура апробирования, нужно постелить плотную ткань. Руки защищаются перчатками, одежда передником. Кислоты разбавляются в специальной емкости, добавляясь тонкой струйкой в дистиллированную воду. Жидкость может нагреться. Перед применением состава на золоте его нужно охладить.
Применение и техника работы с пробирным камнем
Кроме химических реактивов проверить пробу драгметалла можно пробирным камнем. Минерал природного происхождения относится к группе кремниевых сланцев и содержит около 8% углерода, что придает ему черный цвет. Есть также и искусственные пробирные камни.
Применение инструмента начинается с его подготовки. Поверхность протирают касторовым маслом, потом наносят натиры — плотные полосы не более 2-3 мм в ширину и до 20 мм в длину. Рядом наносят вертикали эталонными иглами, отвечающими той или иной пробе. Натиры смачивают реактивами и смотрят за происходящей реакцией. Темный осадок по сравнению с реактивом, свидетельствует о малом содержании золота в сплаве, светлый, наоборот, о более высоком.
Покупка реактивов для золота будет оправданной тратой в том случае, если они будут использоваться в мастерской или ломбарде. Для домашней проверки подойдут менее сложные материалы. Кроме этого, человек, проводящий апробирование, должен обладать определенными навыками, т.к. реагенты стоят дорого, и их нерациональный расход может ударить по карману.
Хлорное золото является одним из определителей чистоты состава материала, используемого для производства ювелирной продукции. Проведение контроля качества сплава производится предприятиями, изготавливающими ювелирную продукцию, мастерскими, имеющими лицензию на работу с драгметаллами, и ломбардами.

Методы идентификации пробы золота
Выпущенные изделия из благородных сплавов перед нанесением клейма соответствующей пробы тщательно проверяются на предприятиях, контролирующих соответствие качества продукции установленным стандартам. Содержание драгоценных компонентов определяют с помощью специальных методов анализа, позволяющих не разрушать состав или производить над ним манипуляции, связанные с разрушением первозданного вида. Опробование производится не только на ювелирных заводах, но и:
- на предприятиях розничной торговли;
- в ювелирных мастерских;
- в учреждениях, выдающих кредиты под залог ювелирных изделий.
Наиболее распространен способ проверки соответствия на кремнистом сланце (пробирном камне). Конечно, у этого метода есть свои недостатки, он является приближенным, но:
- позволяет сохранить целостность изделия;
- отличается простотой в использовании;
- применяется для определения любого вида сплава;
- отличается скоростью проведения анализа.
Использование пробирных иголок, то есть полосок сплавов, соответствующих определенному составу материала и наличию лигатурных компонентов. Чем больше ассортимент используемых материалов входит в стандарт пробы, тем полнее комплект иголок.
Применение химических реактивов относится к разрушающему способу определения состава. Их действие на сплавы однотипно. Если материал содержит высшее количество драгметалла, то реагент не оставит на изделии следа. Если количество лигатурных добавок выше нормы, предусмотренной стандартами, то появится легкая тень. Образованное пятно в опробованном месте укажет на заметную разницу в составе материала.
Несмотря на то что реактивы используются для определения практически всех проб золота, наиболее широко применяемым является специальный кислотный раствор.
Для установления соответствия нанесенного на ювелирное изделие клейма более точный результат покажет используемый реактив хлорное золото. Несмотря на узкую направленность действия данного реагента, его использование позволят определять сплавы широкого спектра, устанавливая наличие долевого содержание золота в составе материала по степени окисления и насыщенности цвета.
Хлористое золото различно действует на разные составы. При навыках работы с реагентом можно определять серебро среди других белых металлов.
Для проверки чистоты сплава реагент наносится на поверхность. Материал от 999 до 585 пробы с реактивом не взаимодействует, а на 583 – оставляет едва заметный след. На сплаве, содержащем 50 % солнечного металла, остается светлое коричневое пятно. Для материала, в состав которого входит 37,5 % драгметалла, реакция на хлорное золото проявляется в виде темного коричневого осадка. Чем ниже проба, тем насыщенней осадок и цвет пятна.
Хлорное золото не вступает в реакцию с химическими элементами платиновой группы и некоторыми видами нержавеющей стали.
Использование чистой азотной кислоты является самым доступным и распространенным способом для идентификации содержания драгметалла в составе материала. При попадании на золото, проба которого ниже 583, происходит реакция с выделением газа. Чем ниже содержание благородного металла, тем интенсивней выделяются пузырьки под каплей кислоты.
Диагностика состава материала
Давно известен факт, что золото не подвергается воздействию внешней среды и устойчиво к любым реагентам. Но купание благородного металла в царской водке способно полностью растворить благородный химический элемент. Такое свойство металла установлено в процессе опытов с разнообразными реагентами.
Как раз реакция на воздействие определенных растворов заложена в методе, позволяющем установить компонентное содержание состава. Действие кислотных реагентов предоставляет возможность провести определение пробы золота от 333 до 900. Кислотные реактивы имеют расширенные стандарты для сплавов, различающихся компонентным содержанием и цветом.
Например, материал 585 пробы в зависимости от содержания лигатурных компонентов может отличаться по цвету. Соответственно реакция состава материала на реагент будет разная.
Осуществить проверку пробы золота кислотным реактивом можно в следующей последовательности:
- механическим способом натереть небольшую пробу из изделия на специальном камне;
- с помощью стеклянной палочки нанести реагент на материал;
- визуально сравнить, как выглядит результат химической реакции с установленными стандартами.
Экспертную проверку пробы сплава драгметалла можно провести, воспользовавшись услугами специальной службы, которая обеспечит получение достоверной информации.
Подтвердить соответствие 585 пробы в изделии можно с помощью специального определителя. Цифровой портативный детектор позволяет в течение нескольких секунд установить содержание состава в диапазоне от 6 до 18 карат.
Подтвердить подлинность 585 пробы можно в домашних условиях с помощью обыкновенного спиртового раствора йода. Для этого в незаметном месте (лучше с обратной стороны ювелирного украшения) необходимо чуть протереть изделие наждаком и в этом месте смазать йодом.Если сплав 585 пробы, то йодный раствор оставит на протертом участке украшения темное пятно. Для сравнения можно провести эксперимент с изделиями, внешне сходными с золотыми (из латуни, меди, бронзы). После проведенных манипуляций на них не останется следа.
Читайте в этой статье:
Одним из точных методов апробирования золота является метод с нанесением реактивов. Реактив на золото — это вещество, по реакции которого можно определить наличие и количество золота в сплаве. В зависимости от пробы золота, реактив также может понадобиться разный. Более того, для более точного определения часто есть необходимость провести опыт несколько раз, используя разные реактивы.
Методика применения реактивов
Для апробирования золота используется три типа реактивов:
- кислотные, или стандартные;
- хлорное золото;
- йодистый калий.
В зависимость от используемого реактива для определения пробы понадобится разное время. Быстрее всего действует йодистый калий — 2–5 сек. Самой медленной является реакция для кислотного реактива, предназначенного для пробы золота выше 750 и самого металла.

Кислотный реактив для определения золота и платины
Для того чтобы на глаз определить, какой понадобится реактив, нужно знать некоторые характеристики золота. Чем выше проба, тем металл мягче. Плотность будет выше у золота более высокой пробы. Для того чтобы определить плотность металла, необходимо взвесить изделие на весах, а потом в жидкости. Если разделить одно значение на другое мы и получим плотность. Далее для определения пробы пользуются методикой:
- Если золота содержится около 37 процентов, что соответствует 375 пробе, то металл сначала апробируется хлоридом золота, после чего реактивом для 375 пробы.
- Для 500 пробы используется такой же порядок — хлорид золота, далее реактив для этой пробы. Так как 500 проба чаще всего представляет 585 пробу, но немного загрязненную, поэтому дополнительно может быть проверена кислотным реактивом для этой пробы.
- Золотые сплавы, имеющие белый цвет, в которых золота содержится предположительно до 60 %, — хлоридом золота.
- Золотые сплавы 750 пробы, включая белое золото, — реактивом до 750 пробы, можно уточнить хлоридом золота, не является ли изделие грубой подделкой.
- Сплавы, в которых золота содержится более 80 %, — раствором йодистого калия, так же как и при 750 пробе возможно уточнение при помощи хлорида золота.
Кислотные реактивы
Все кислотные реактивы имеют однотипное действие, они оставляют светлое пятно на металле той пробы, для которой они предназначены, или никак не реагируют. На металл более высокой пробы тоже не реагируют и оставляют коричневое пятно, если проба меньше той, для которой предназначен реактив. В его приготовлении используются:
- азотная кислота плотностью 1,4;
- соляная кислота, плотностью 1,19;
- дистиллированная вода.
Для разных проб золота готовятся растворы в таких пропорциях:
| Проба | Азотная Кислота | Соляная кислота | Вода |
|---|---|---|---|
| 375 | 0.595 | 0.405 | |
| 500 | 1 | ||
| 583/585 | 0.46 | 4 капли | 0.54 |
| 750 | 0.593 | 0.011 | 0.396 |
| 833 | 0.687 | 0.013 | 0.3 |
| 900 | 0.692 | 0.013 | 0.295 |
| 958 | 0.787 | 0.02 | 0.193 |
Кислотный реактив на 500 пробу золота можно также считать универсальным для любой пробы. Он представляет собой чистую азотную кислоту, которая будет реагировать на все виды золота, проба которых ниже 583. Он является наиболее дешевым и доступным. На всех сплавах, содержащих золота менее половины, под каплей будут выделяться пузырьки. Чем ниже проба, тем выделение будет интенсивнее.
Если золота не содержится вовсе, реакция произойдет мгновенно и появится зеленая пена, которая будет сопровождаться шипением. На серебре невысокой пробы она оставит сероватое пятно, а при пробе ниже 800 реакция будет такая же, с пузырьками. На серебре ниже 600 пробы азотная кислота будет кипеть. Такой реактив часто применяется как начальный для приблизительного определения исследуемого металла.
Хлорное золото
Хлорное золото часто используется для апробирования изделий, проба и состав которых неизвестны. Наибольшую эффективность оно имеет, когда нужно определить подделки, например, если изделие только покрыто слоем золота или этого металла и вовсе нет. Этот реактив применяется, если необходимо апробировать 500 и 583/585 пробы золота.

Реактив хлорное золото — не только для определения золота, с его помощью определяют и другие разновидности драгоценных металлов и сплавов. Для того чтобы провести такой анализ, на поверхность исследуемого металла наносят каплю реактива и ожидают. Спустя некоторое время, образуется пятно определенного цвета, по которому и определяют, с каким металлом имеют дело.
| Цвет металла | Цвет пятна | Время реакции | Определяемый металл |
|---|---|---|---|
| Белый | Темно-зеленый | До 2 сек. | Серебро высокой пробы |
| От желтого до темно-желтого, сопровождается выделением газа | До 2 сек. | Алюминий | |
| Черный | Приблизительно полминуты | Олово | |
| Серовато-белый | Не оказывает действия | 30–40 сек. | Платина |
| От желтого, быстро становится очень темным | До 2 сек. | Цинк | |
| Синевато-белый | Грязно-желтый | До 2 сек. | Свинец |
| Желтый | Не оказывает действия | До 2 сек. | Высокопробное золото в сплаве с серебром |
| Каштановый | До 6 минут | Низкопробные сплавы золота с серебром и медью | |
| Черный | До 2 сек. | Латунь | |
| Бледно-желтый | Черный | До 2 сек. | Низкопробное серебро, в лигатуре — медь |
| Красный | Не оказывает действия | До 2 сек. | Высокопробный сплав золота. В лигатуре — медь |
| Золотистый | До 6 минут | Низкопробное золото в сплаве с медью | |
| Черный | До 2 сек. | Медь |
Чем ниже проба золота, тем темнее будет выглядеть пятно на поверхности металла. На золоте стандартной и самой распространенной у нас пробы 585 хлорид золота даст коричневое пятно, на белом золоте той же пробы — оранжевое. На 500 — темно-каштановое, на 375 пробе хлорид золота оставит зеленое пятно. Данный реактив хорошо взаимодействует с золотом и серебром и не оказывает никакого влияния на платину и металлы платиновой группы. Также он плохо реагирует с некоторыми видами стали.
Раствор йодида калия
Этот раствор применяется для проверки сплавов золота с высокой пробой, а также определения хороших подделок, то есть тех, которые сделаны из сплавов, инертных к большинству веществ. Действует раствор так:
- На сплаве с содержанием золота выше 90 % реактив образует яркое красное пятно.
- На золотых сплавах с содержанием золота от 80 до 90 % — бордовое пятно. Такой сплав золота часто содержится в ломе, который остался после коронок или протезов для зубов.
- На подделках из сплавов, которые имеют высокую устойчивость, образуется черное или зеленое, но чернеющее пятно. Реакция сопровождается выделением пузырьков.
Описание реакций для проб
Таким образом, можно считать, что проба определена, когда для нее наблюдаются такие реакции:
- 375: при реакции с хлоридом золота образуется пятно зеленовато-коричневого цвета, реакция при взаимодействии с реактивом из кислоты для этой пробы отсутствует.
- 500: при взаимодействии с хлоридом золота образуется светло-коричневое пятно, со стандартным реактивом — прозрачная капля. Если для уточнения был использован реактив для 585 пробы, на 500 пробе будет пятно каштанового цвета.
- 500, белое: от хлорида золота — пятно коричневого цвета.
- 585: от хлорида золота — прозрачная капля, от реактива — светлое пятно.
- 585, белое: от хлорида золота останется пятно золотистого цвета.
- 750: едва уловимое пятно от хлорида золота, то же самое и для реактива из кислот.
- 750, белое: от реактива — светло-коричневое пятно.
- 800: темно-красное пятно — от йодида калия.
- Выше 900: красное пятно — от йодида калия.
Порядок проведения апробации.
Прежде всего, проводится осмотр изделия. Внимание обращается на клеймо; иногда, если оно фальшивое, это можно определить визуально. Например, могут быть асимметричные символы, а сами формы и изображения — выглядеть кривыми. Далее необходимо определить принадлежность сплава к группе высокопробного или низкопробного золота.
Перед началом исследования поверхность изделия на небольшой площади зачищается, так как оно может быть покрыто слоем из другого металла, например, быть просто позолоченным или родированным. Зачистка проводится аккуратно, далеко от пробирного клейма, с внутренней стороны изделия.
На зачищенную поверхность наносится капля вещества. Она должна очень аккуратно лечь на украшение. При определении результатов важно точно соблюдать все рекомендации и следить за временем нахождения капли на поверхности изделия. После того как реакция закончилась, каплю реактива удалить.
Использование реактивов на золото — не единственный метод для определения его пробы. Это исследование также можно провести с использованием пробирного камня и пробирных игл. Существует также и специальный прибор для апробирования золота. Но реактивы обладают достаточной точностью и удобны в использовании, скажем, в небольших мастерских.
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК |
- 13453-07-1

Y
- ЧЕБИ: 30076

Y
- 24244

Y
- MD5420000
- 15443PR153

Y
Y Ключ: RJHLTVSLYWWTEF-UHFFFAOYSA-K
Y
Золото (III) хлорид , традиционно называют аурический хлоридом , представляет собой химическое соединение , из золота и хлора . С молекулярной формулой Au 2 Cl 6 название трихлорид золота является упрощением, относящимся к эмпирической формуле AuCl 3 . В римские цифры в названии указывают , что золото имеет степень окисления +3, который является общим для соединений золота. Существует также другой родственный хлорид золота - хлорид золота (I) (AuCl). Хлористоводородная кислота , HAuCl 4 , продукт, образующийся при растворении золота в царской водке , иногда называют «хлоридом золота» или «кислотным трихлоридом золота». Хлорид золота (III) очень гигроскопичен и хорошо растворяется в воде, а также в этаноле . Разлагается выше 160 ° C или на свету.
СОДЕРЖАНИЕ
- 1 Структура
- 2 Подготовка
- 3 реакции
- 4 Приложения в органическом синтезе
- 5 ссылки
- 6 Внешние ссылки
Состав
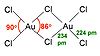
AuCl 3 существует в виде димера с мостиковыми связями хлорида как в твердом, так и в парообразном состоянии, по крайней мере, при низких температурах. Аналогично ведет себя бромид золота (III) . По структуре аналогичен хлориду йода (III) .
В хлориде золота (III) каждый центр золота имеет плоскую квадратную форму, что типично для металлического комплекса с числом электронов ad 8 . Связь в AuCl 3 считается до некоторой степени ковалентной .
Подготовка
Хлорид золота (III) чаще всего получают пропусканием газообразного хлора над золотым порошком при 180 ° C:
Реакцию хлорирования можно проводить в присутствии хлорида тетрабутиламмония , продуктом которого является липофильная соль тетрахлораурата тетрабутиламмония.
Другой способ получения - с использованием золотохлористоводородной кислоты , которую получают путем растворения золотого порошка в царской водке с образованием хлористоводородной кислоты:
Au + HNO 3 + 4 HCl → HAuCl 4 + 2 H 2 O + NO
Затем полученную хлористоводородную кислоту нагревают с получением Au 2 Cl 6 :
Реакции

При контакте с водой AuCl
3 образует кислые гидраты и конъюгат основания [AuCl
3 (ОЙ)] -
. Может быть уменьшено Fe 2+
вызывая осаждение элементарного золота из раствора.
Безводный AuCl 3 начинает разлагаться до AuCl примерно при 160 ° C; однако это, в свою очередь, подвергается диспропорционированию при более высоких температурах с образованием металлического золота и AuCl 3 .
AuCl 3 → AuCl + Cl 2 (> 160 ° C) 3 AuCl → AuCl 3 + 2 Au (> 420 ° C)
AuCl 3 является кислотой Льюиса и легко образует комплексы . Например, он реагирует с соляной кислотой с образованием золотохлористоводородной кислоты ( HAuCl
4 ):
Другие источники хлорида, такие как KCl , также превращают AuCl 3 в AuCl. -
4 . Водные растворы AuCl 3 реагируют с водным основанием, таким как гидроксид натрия, с образованием осадка Au (OH) 3 , который растворяется в избытке NaOH с образованием аурата натрия (NaAuO 2 ). При осторожном нагревании Au (OH) 3 разлагается на оксид золота (III) , Au 2 O 3 , а затем на металлическое золото.
Хлорид золота (III) является отправной точкой для синтеза многих других соединений золота. Например, реакция с цианидом калия дает водорастворимый комплекс K [Au (CN) 4 ]:
AuCl
3 + 4 KCN → K [Au (CN)
4 ] + 3 KCl
Приложения в органическом синтезе
AuCl 3 вызвал интерес химиков-органиков как слабокислый катализатор для различных реакций, хотя коммерческие преобразования не применялись. Соли золота (III) , особенно Na [AuCl 4 ] (полученные из AuCl 3 + NaCl ), являются альтернативой солям ртути (II) в качестве катализаторов реакций с участием алкинов . Иллюстративной реакцией является гидратация концевых алкинов с образованием ацетильных соединений.

Некоторые алкины подвергаются аминированию в присутствии катализаторов на основе золота (III). Золото катализирует алкилирование определенных ароматических колец и превращение фуранов в фенолы . Так , например, смесь ацетонитрила и золото (III) хлорид катализирует алкилирование 2-метилфурана по метилвинилкетону в 5-положении:

Эффективность этой реакции с золотоорганическими соединениями заслуживает внимания, поскольку и фуран, и кетон чувствительны к побочным реакциям, таким как полимеризация в кислых условиях. В некоторых случаях, когда присутствуют алкины , иногда образуются фенолы (Ts = тозил ):

Эта реакция включает перегруппировку, которая дает новое ароматическое кольцо.
В качестве стехиометрического реагента хлорид ауры реагирует с бензолом (и множеством других аренов) в чрезвычайно мягких условиях (минуты при комнатной температуре) с образованием димерного дихлорида фенилзолота (III):
Читайте также:

