Фосфат серебра какого цвета
Опубликовано: 24.07.2024
Фосфат серебра или ортофосфат серебра - это светочувствительное, желтое, нерастворимое в воде химическое соединение, состоящее из ионов серебра и фосфата формулы Ag 3 PO 4 .
Фосфат серебра образуется в виде желтого осадка в результате реакции между растворимым соединением серебра, таким как нитрат серебра, с растворимым ортофосфатом ; произведение его растворимости составляет 8,89 × 10 -17 моль 4 · дм -12 . Реакция осаждения имеет аналитическое значение и может быть использована в качественных или количественных тестах на фосфаты.
Это соединение растворяется азотной кислотой или аммиаком . Он также может образовываться в виде крупных кристаллов при постепенной потере аммиака из аммиачного раствора фосфата серебра; реакция может быть использована для количественного анализа фосфат-ионов. В зависимости от метода приготовления могут быть получены различные кристаллические формы фосфата серебра с одинаковой структурой решетки.
Использует
Помимо того , что осаждение фосфата серебра играет важную роль в аналитической химии , оно также используется при окрашивании серебром биологических материалов (после восстановления до металлического серебра) - в качестве увеличивающего агента для фосфата.
Фосфат серебра также нашел применение в ранней фотографии в качестве светочувствительного агента.
В 2010 году сообщалось, что фосфат серебра имеет высокий (90%) квантовый выход в качестве фотокатализатора для фотохимического расщепления воды в видимом свете и для производства активированного кислорода тем же методом.
Фосфат серебра также является потенциальным материалом для придания материалам антибактериальных свойств ионов серебра.
Другие фосфаты серебра
Пирофосфат серебра Ag 4 P 2 O 7 (CAS № 13465-97-9) может быть приготовлен в виде белого осадка в результате реакции серебра (I) иионов пирофосфата . Как и ортофосфат серебра, он светочувствителен. Ортофосфат серебра становится красным на свету. Он имеет плотность 5,306 г / см 3 и температуру плавления 585 ° C. Также существует гидрат, который разлагается при 110 ° C.
Метафосфат серебра (AgPO 3 ) (CAS № 13465-96-8) представляет собой белое твердое вещество с плотностью 6,370 г / см 3 и температурой плавления 482 ° C. Также существует гидрат, который разлагается при 240 ° C.
| Ортофосфат серебра (I) | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | Ag3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | желтые кубические кристаллы |
| Молярная масса | 418,58 г/моль |
| Плотность | 6,370 г/см³ |
| Термические свойства | |
| Температура плавления | 849 °C |
| Химические свойства | |
| Растворимость в воде | 0,00065 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7784-09-0 |
| Рег. номер PubChem | 140592 |
| Рег. номер EINECS | 232-049-0 |
| Регистрационный номер EC | 232-049-0 |
Ортофосфат серебра(I) — неорганическое соединение, соль металла серебра и ортофосфорной кислоты с формулой Ag3PO4, жёлтые кристаллы, не растворяется в воде.
Содержание
Получение
- Действие гидрофосфата натрия на нитрат серебра(I):

Физические свойства
Ортофосфат серебра(I) образует жёлтые кристаллы кубической сингонии, пространственная группа P m3n, параметры ячейки a = 0,599 нм, Z = 2.
Чувствителен к свету. Мало растворим в воде ПР(Ag3PO4)=1,8·10 −16 (t=25 °C). Растворяется в аммиаке, минеральных кислотах. Молярная электропроводность при бесконечном разведении при 25 °C равна 392,7 Cм·см²/моль.
Применение
Применяют для изготовления светочувствительной бумаги и эмульсий.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М .: Мир, 1972. — Т. 2. — 871 с.
Wikimedia Foundation . 2010 .
- Ортофосфат меди(II)
- Ортофосфат стронция
Смотреть что такое "Ортофосфат серебра(I)" в других словарях:
Ортофосфат марганца(II) — Общие Систематическое наименование Ортофосфат марганца(II) Традиционные названия Фосфорнокислый марганец Химическая формула Mn3(PO4)2 Физические свойства … Википедия
Ортофосфат хрома(III) — Общие Систематическое наименование Ортофосфат хрома(III) Традиционные названия Фосфорнокислый хром Химическая формула CrPO4 Физические свойства … Википедия
серебра ортофосфат — sidabro ortofosfatas statusas T sritis chemija formulė Ag₃PO₄ atitikmenys: angl. silver ortophosphate rus. серебра ортофосфат; серебро фосфорнокислое ryšiai: sinonimas – trisidabro tetraoksofosfatas … Chemijos terminų aiškinamasis žodynas
Ортофосфат — Ортофосфорная кислота Общие Систематическое наименование Ортофосфорная кислота Хи … Википедия
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Перманганат серебра — Общие Систематическое наименование Перманганат серебра Традиционные названия Марганцовокислое серебро Химическая формула AgMnO4 Физические свойства … Википедия
Хромат серебра — Общие Систематическое наименование Хромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2CrO4 Физические свойства … Википедия
Фульминат серебра — Общие Систематическое наименование Фульминат серебра(I) Традиционные названия Гремучее серебро Химическая формула AgCNO Эмпирическая формула AgCNO Физические свойства … Википедия
Нитрат серебра(I) — Под вечный гул вертящихся колес. Нитрат серебра … Википедия
Ацетиленид серебра — Общие … Википедия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК |
- 7784-09-0

Y
- 232-049-0
- ZL6T4Y1XP8

Y

Фосфат серебра или же ортофосфат серебра представляет собой светочувствительное, желтое, нерастворимое в воде химическое соединение, состоящее из серебро и фосфат ионы формулы Ag3PO4.
Содержание
- 1 Синтез, реакции и свойства
- 2 Использует
- 3 Другие фосфаты серебра
- 4 Рекомендации
Синтез, реакции и свойства
Фосфат серебра образуется в виде желтого осадка в результате реакции между растворимыми соединениями серебра, такими как нитрат серебра с растворимым ортофосфат; [2] это произведение растворимости 8,89 × 10 −17 моль 4 · Дм −12 . [3] [4] Реакция осаждения аналитически значима. [5] и может использоваться в качественных или количественных тестах на фосфаты.
Это соединение растворяется азотной кислотой или аммиак. [2] Он также может образовываться в виде крупных кристаллов при постепенной потере аммиака из аммиачного раствора фосфата серебра; реакция может быть использована для количественного анализа фосфат-ионов. [6] В зависимости от метода приготовления могут быть получены различные кристаллические формы фосфата серебра с одинаковой структурой решетки. [6]
Использует
Помимо того, что он важен в аналитическая химия, осаждение фосфата серебра также используется в окрашивание серебром биологических материалов (после восстановления до металлического серебра) - как усилитель для фосфатов. [7]
Фосфат серебра также нашел применение в ранней фотографии в качестве светочувствительного агента. [8]
В 2010 году фосфат серебра имел высокий (90%) квантовый выход как фотокатализатор для видимого света фотохимическое расщепление воды и для производства активированного кислорода тем же способом. [9] [10]
Фосфат серебра также является потенциальным материалом для придания материалам антибактериальных свойств ионов серебра. [11]
Другие фосфаты серебра
Пирофосфат серебра Ag4п2О7 (№ КАС 13465-97-9) [12] может быть приготовлен в виде белого осадка из реакции серебра (I) и пирофосфат ионы. Как и ортофосфат серебра, он светочувствителен. Ортофосфат серебра становится красным на свету. [13] Имеет плотность 5,306 г / см. 3 и точка плавления 585 ° C. [14] Также существует гидрат, который разлагается при 110 ° C. [14]
Метафосфат серебра (AgPO3) (CAS № 13465-96-8) [15] белое твердое вещество плотностью 6,370 г / см 3 и точка плавления 482 ° C. Также существует гидрат, который разлагается при 240 ° C. [14]
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК |
- 7784-09-0

Y
- 232-049-0
- ZL6T4Y1XP8

Y

Фосфат серебра или ортофосфат серебра - это светочувствительное, желтое, нерастворимое в воде химическое соединение, состоящее из ионов серебра и фосфата формулы Ag 3 PO 4 .
Содержание
- 1 Синтез, реакции и свойства
- 2 использования
- 3 Прочие фосфаты серебра
- 4 ссылки
Синтез, реакции и свойства [ править ]
Фосфат серебра образуется в виде желтого осадка в результате реакции между растворимым соединением серебра, таким как нитрат серебра, с растворимым ортофосфатом ; [2] его произведение растворимости составляет 8,89 × 10 −17 моль 4 · дм −12 . [3] [4] Реакция осаждения имеет аналитическое значение [5] и может использоваться в качественных или количественных тестах на фосфаты.
Это соединение растворяется азотной кислотой или аммиаком . [2] Он также может образовываться в виде крупных кристаллов при постепенной потере аммиака из аммиачного раствора фосфата серебра; реакция может быть использована для количественного анализа фосфат-ионов. [6] В зависимости от метода приготовления могут быть получены различные кристаллические формы фосфата серебра с одинаковой структурой решетки. [6]
Использует [ редактировать ]
Помимо того , что осаждение фосфата серебра играет важную роль в аналитической химии , оно также используется при окрашивании серебром биологических материалов (после восстановления до металлического серебра) - в качестве увеличивающего агента для фосфата. [7]
Фосфат серебра также нашел применение в ранней фотографии в качестве светочувствительного агента. [8]
В 2010 году сообщалось, что фосфат серебра имеет высокий (90%) квантовый выход в качестве фотокатализатора для фотохимического расщепления воды в видимом свете и для производства активированного кислорода тем же методом. [9] [10]
Фосфат серебра также является потенциальным материалом для придания материалам антибактериальных свойств ионов серебра. [11]
Другие фосфаты серебра [ править ]
Пирофосфат серебра Ag 4 P 2 O 7 (CAS № 13465-97-9) [12] может быть получен в виде белого осадка в результате реакции серебра (I) и ионов пирофосфата . Как и ортофосфат серебра, он светочувствителен. Ортофосфат серебра становится красным на свету. [13] Он имеет плотность 5,306 г / см 3 и температуру плавления 585 ° C. [14] Также существует гидрат, который разлагается при 110 ° C. [14]
Метафосфат серебра (AgPO 3 ) (CAS № 13465-96-8) [15] представляет собой белое твердое вещество с плотностью 6,370 г / см 3 и температурой плавления 482 ° C. Также существует гидрат, который разлагается при 240 ° C. [14]
При сгорании фосфора образуется густой белый дым, осаждающийся на стенках сосуда в виде белого порошка. Это фосфорный ангидрид Р2О5. Прилив в сосуд воды и взболтав ее, получим сначала мутную жидкость. Но вскоре муть исчезает, и получается прозрачный раствор, окрашивающий синий лакмус в красный цвет.
Реакция присоединения воды к фосфорному ангидриду идет в несколько ступеней. Сначала к молекуле ангидрида присоединяется одна молекула воды, и получается метафосфорная кислота НРО3, затем вторая, и получается ортофосфорная, или фосфорная, кислота Н3РО4:
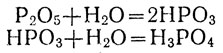
Фосфорный ангидрид энергично присоединяет не только жидкую воду, но и ее пары. Поэтому он применяется для осушения газов.
Фосфорная кислота Н3РО4 имеет структурную формулу
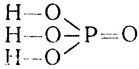
Это твердое вещество, хорошо растворимое в воде. В отличие от азотной, фосфорная кислота нелетуча. В растворе она диссоциирует ступенчато:
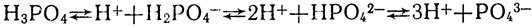
Фосфорная кислота относится к слабым кислотам.
При диссоциации многоосновных кислот каждый последующий ион водорода отщепляется труднее, чем предыдущий, из-за возрастания заряда аниона, притяжение которого ему приходится преодолевать. Поэтому в растворах фосфорной кислоты наряду с нерасщепленными молекулами Н3РО4 много ионов Н2РО4, очень мало ионов PО4 2- и ничтожно мало ионов РО4 3- .
Фосфорная кислота взаимодействует только с металлами, расположенными в электрохимическом ряду напряжений левее водорода. Ее средние соли называются фосфатами. В зависимости от количества добавленного к раствору фосфорной кислоты основания в ее молекулах могут заместиться металлом один, два или все три атома водорода:
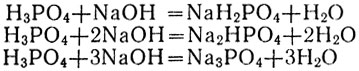
Поэтому с одним и тем же металлом фосфорная кислота может образовывать три разные по составу и свойствам соли. Если в молекулах фосфорной кислоты заместился металлом лишь один атом водорода, а остальные два атома водорода остались связанными с кислотным остатком в одновалентном анионе Н2РО4 - , то соль называется дигидрофосфатом (один - два). Если в молекулах кислоты заместились металлом два атома водорода, а с кислотным остатком остался связанным лишь один, образуя ион НРО4 2- , то соль называется гидрофосфатом. Если же все атомы водорода замещены металлом, то соль называется просто фосфатом. Приведем пример таких солей:
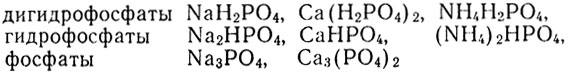
Дигидрофосфаты всех металлов хорошо растворимы в воде. Фосфаты нерастворимы в воде, за исключением фосфатов щелочных металлов. Гидрофосфаты по растворимости занимают промежуточное положение между дигидрофосфатами и средними фосфатами. Все нерастворимые в воде фосфаты растворяются при приливании сильных кислот, так как переходят в кислые соли - дигидрофосфаты, например:
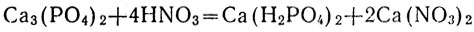
или в ионной форме:
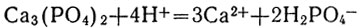
Реактивом на ионы РО4 3- служит нитрат серебра. При прибавлении его к раствору, содержащему эти ионы, образуется осадок фосфата серебра:
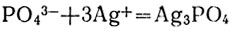
Фосфат серебра ярко-желтого цвета и, как все фосфаты, растворяется при добавлении раствора сильной кислоты.

- Опишите физические и химические свойства: а) фосфорного ангидрида, б) фосфорной кислоты.
- Какие ионы содержатся в растворе фосфорной кислоты?
- Напишите формулы дигидрофосфатов, гидрофосфатов и фосфатов калия и кальция.
- Какие из нижеперечисленных солей фосфорной кислоты хорошо растворимы и какие практически нерастворимы в воде: AlPO4, Mg(H2PO4)2, (NH4)2HPO4, Pb3(PO4)2, Fe3(PO4)2, FePO4, K3PO4? Назовите каждую соль.
- Составьте уравнения реакций фосфорной кислоты: а) с металлами, б) с окислами металлов, в) с основаниями.
- * К раствору гашеной извести приливали порцию за порцией раствор фосфорной кислоты. Сначала получился осадок, который исчез при дальнейшем прибавлении кислоты. Объясните эти явления, составьте уравнения реакций.
- Какие вещества и в какой последовательности будут получаться: а) при пропускании в раствор фосфорной кислоты аммиака, б) при постепенном приливании к раствору фосфорной кислоты раствора едкого кали, в) при постепенном приливании к раствору гидроокиси кальция раствора фосфорной кислоты? Какие явления будут при этом наблюдаться (образование или растворение осадков)? Происходящие реакции изобразите молекулярными и ионными уравнениями.
- * К раствору, содержащему 2 моля фосфорной кислоты, прибавили раствор, содержащий 3 моля едкого кали. Воду выпарили. Каков состав выпавших кристаллов?
- Растворы всех гидрофосфатов окрашивают фенолфталеин в малиновый цвет. Почему? Напишите в ионной форме уравнение реакции между гидрофосфатом и водой. Как называются такие реакции?
Читайте также:

